KN-355
KN-355
Indikácia: KEYTRUDA je v kombinácii s chemoterapiou indikovaná na liečbu lokálne rekurentného neresekovateľného alebo metastatického trojnásobne negatívneho karcinómu prsníka u dospelých, ktorých nádory vykazujú expresiu PD-L1 s CPS ≥ 10 a ktorí v minulosti neboli liečení chemoterapiou pre metastatické ochorenie (pozri časť 5.1 SPC).1
Dizajn klinickej štúdie KEYNOTE-3552
Liek KEYTRUDA® (pembrolizumab) bol skúmaný s tromi rôznymi chemoterapeutickými režimami (paklitaxel, nab-paklitaxel alebo gemcitabín s karboplatinou) v multicentrickom, randomizovanom, dvojito zaslepenom, placebom kontrolovanom klinickom hodnotení fázy 3 u 847 pacientov s lokálne rekurentným neresekovateľným alebo metastatickým TNBC.2
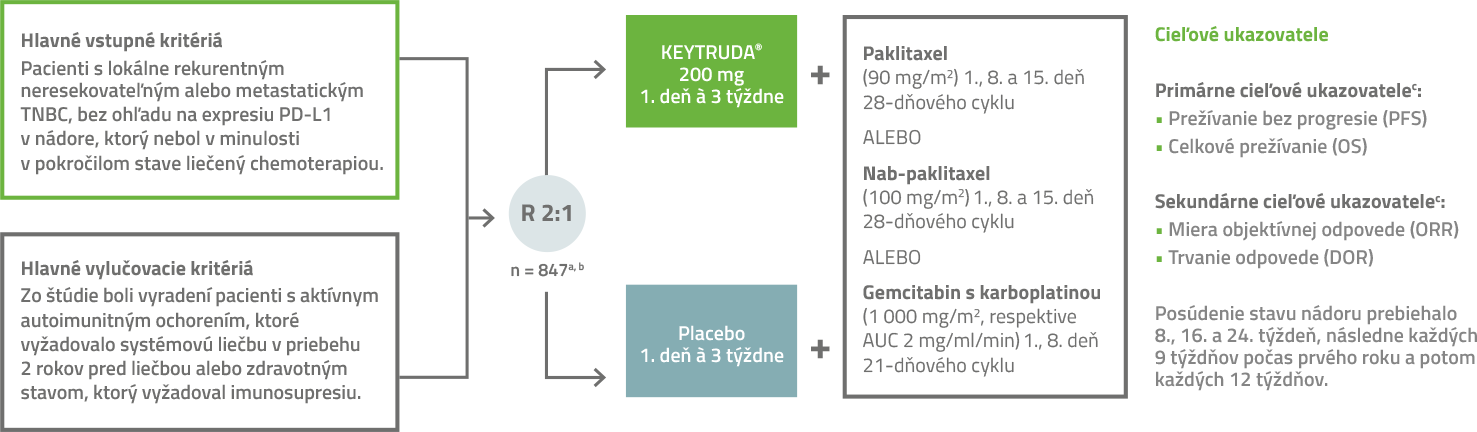
Liečba liekom KEYTRUDA® alebo placebom pokračovala do progresie ochorenia, neprijateľnej toxicity alebo do momentu maximálne 24 mesiacov.
a Randomizácia (2 : 1) bola stratifikovaná podľa chemoterapeutického režimu (paklitaxel alebo nab-paklitaxel alebo gemcitabín s karboplatinou), nádorovej expresie PD-L1 (CPS ≥ 1 vs. CPS < 1) stanovenej pomocou súpravy PD-L1 IHC 22C3 pharmDx a predchádzajúcej liečby rovnakou triedou chemoterapie v neoadjuvantnom podaní (áno vs. nie).
b Všetka študijná medikácia bola podávaná intravenóznou infúziou.
c Hodnotené zaslepenou centrálnou nezávislou komisiou (BICR). PFS hodnotené BICR na základe kritérií hodnotenia odpovede na liečbu pri solídnych nádoroch (RECIST v1.1), modifikovaných na sledovanie maximálne 10 cieľových lézií a maximálne piatich cieľových lézií na vyšetrovaný orgán v podskupine pacientov s CPS ≥ 10.
AUC = plocha pod krivkou; IHC = imunohistochémia
Vstupné charakteristiky pacientov v štúdii KEYNOTE-3552
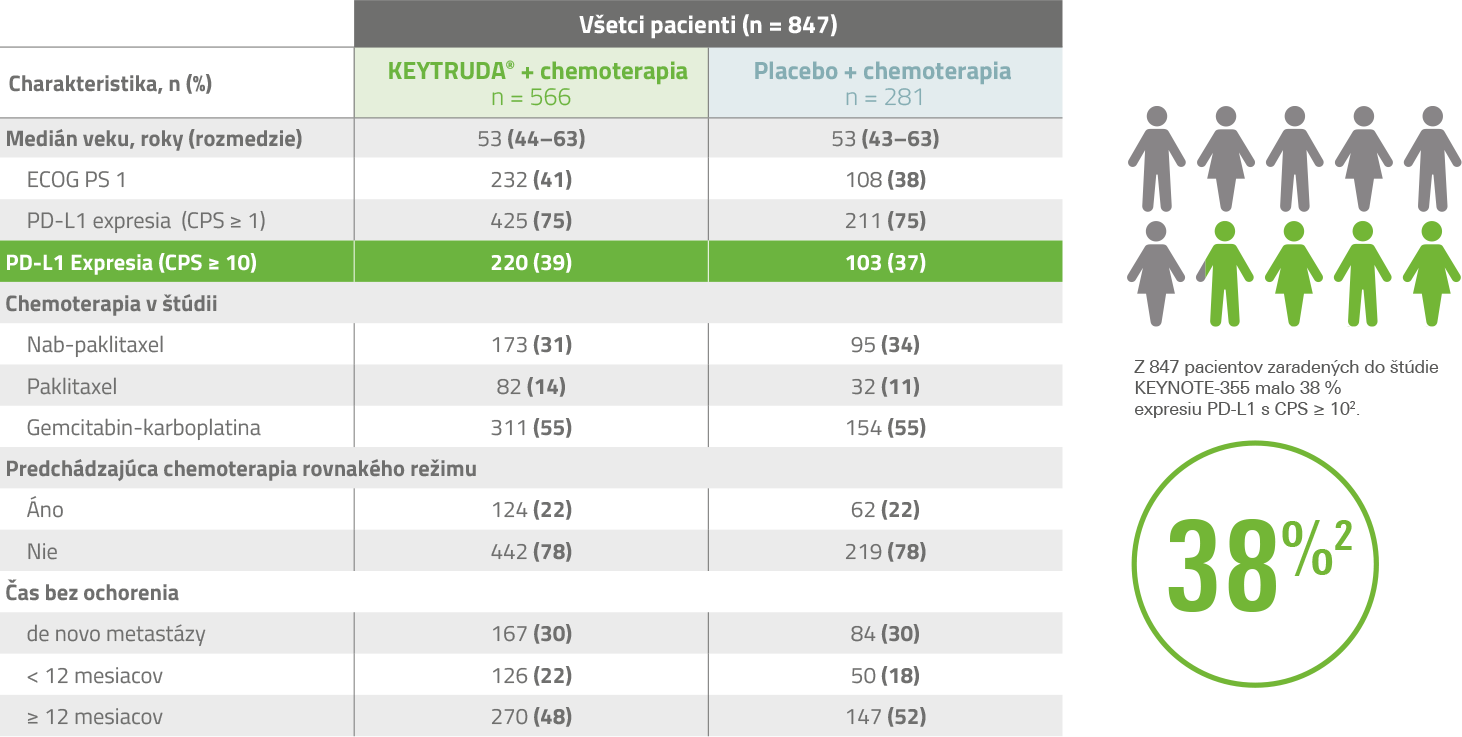
Liečebné režimy v klinickej štúdii KEYNOTE-3551

U pacientov liečených liekom KEYTRUDA® v kombinácii s chemoterapiou bolo dosiahnuté 34 % zníženie rizika progresie alebo úmrtia3, *
* Štúdia preukázala 34 % zníženie rizika progresie alebo úmrtia (HR = 0,66; 95 % Cl 0,50 – 0,88) u pacientov s nádormi exprimujúcimi PD-L1 s CPS ≥ 10 randomizovaných do liečebného ramena liekom KEYTRUDA® v kombinácii s chemoterapiou v porovnaní s placebom v kombinácii s chemoterapiou.1, 2
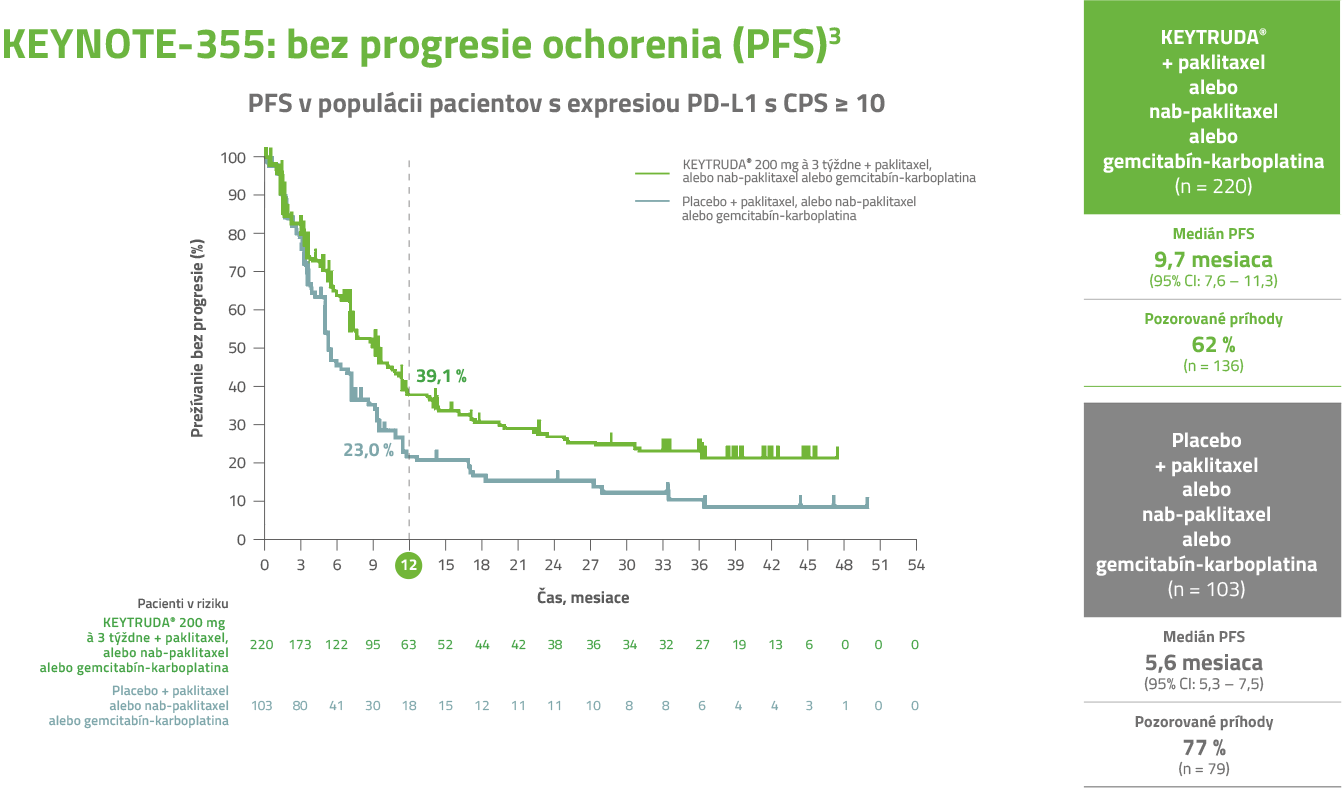
a HR na základe stratifikovaného Coxovho regresného modelu. Jednostranná hodnota p na základe stratifikovaného log rank testu.
U pacientov liečených liekom KEYTRUDA® v kombinácii s chemoterapiou bola dosiahnutá 27 % redukcia rizika úmrtia 3, 4
KEYNOTE-355: celkové prežívanie pacientov (OS) 3, 4
Medián celkového prežívania u pacientov s pokročilým TNBC a expresiou PD-L1 s CPS ≥ 10 bol v ramene s liekom KEYTRUDA® + chemoterapia významne dlhší vs. placebo + chemoterapia2, 4
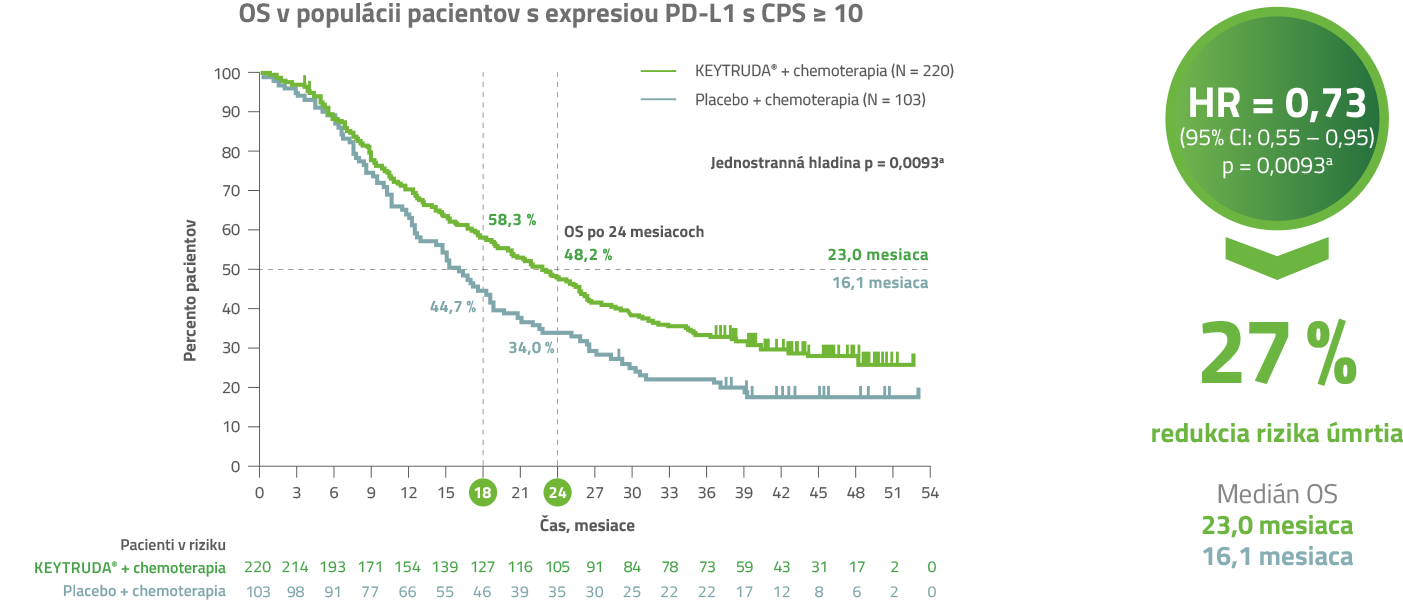
Upravené podľa súhrnu údajov o lieku KEYTRUDA® (pembrolizumab).1
a Bola dosiahnutá dopredu špecifikovaná hladina významnosti p = 0,0113. Pomer rizík (CI) podľa Coxovho regresného modelu s liečbou ako premennou, stratifikovaného podľa stratifikačných faktorov pri randomizácii. Dátum uzávierky: 15. júna 2021.4
Miera objektívnej odpovede (ORR)3
Hodnotené bolo u 220 pacientov s CPS ≥ 10 v ramene KEYTRUDA® + paklitaxel alebo nab-paklitaxel alebo gemcitabín-karboplatina a u 103 pacientov s CPS ≥ 10 v ramene placebo + paklitaxel alebo nab-paklitaxel alebo gemcitabín-karboplatina.

Trvanie odpovede (DOR) v populácii pacientov s expresiou PD-L1 s CPS ≥ 103

Nežiaduce reakcie súvisiace s liečbou liekom KEYTRUDA® (TRAE)3
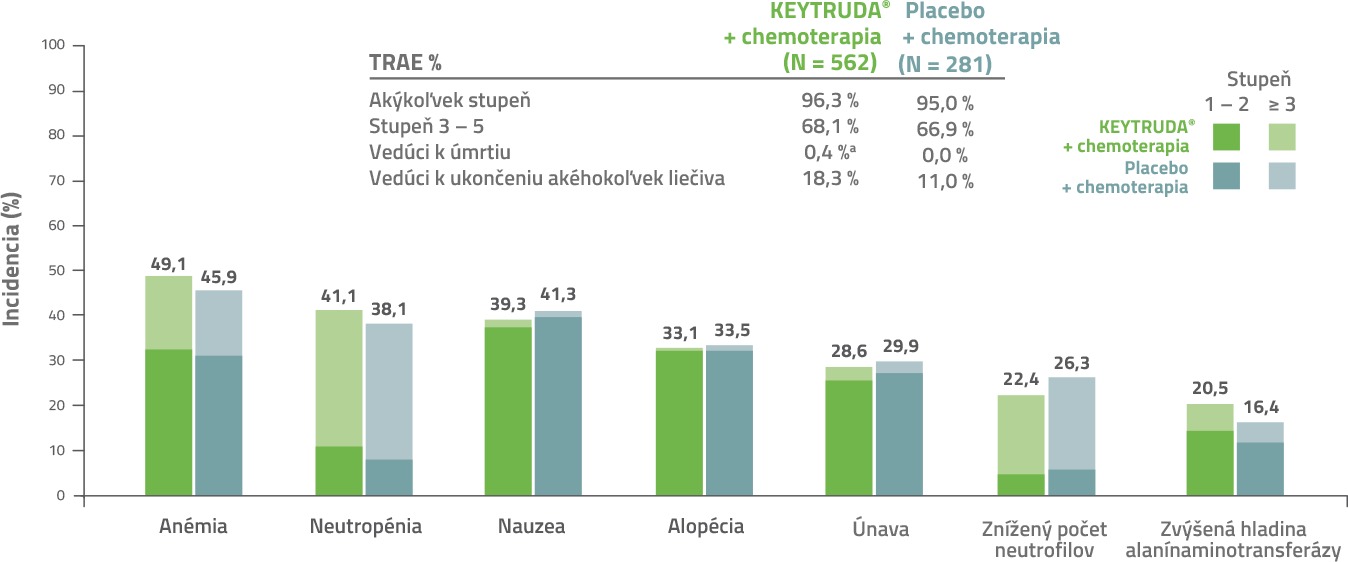
Nežiaduce reakcie akéhokoľvek stupňa s výskytom ≥ 20 % v ramene KEYTRUDA® + chemoterapia a ramene placebo + chemoterapia.
a 1 pacient z dôvodu akútneho poškodenia obličiek a 1 pacient z dôvodu pneumónie. Dátum ukončenia databázy 15. 6. 2021.
Imunitne podmienené nežiaduce účinky a reakcie súvisiace s infúziou3
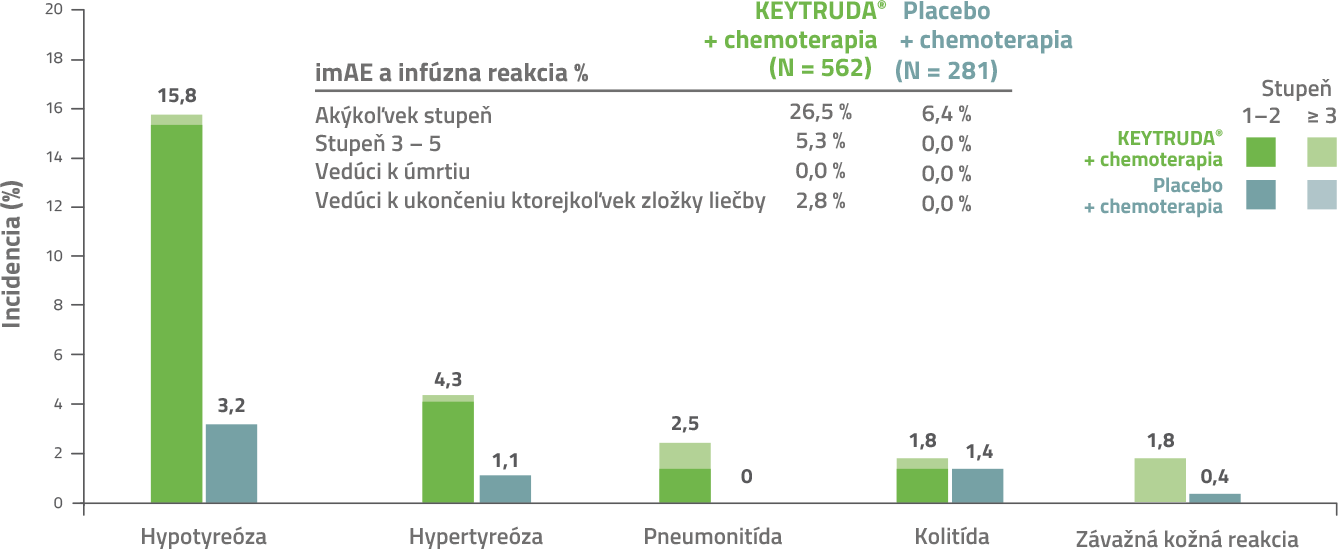
Imunitne sprostredkované nežiaduce príhody akéhokoľvek stupňa s výskytom ≥ 10 % v ramene KEYTRUDA® + chemoterapia a ramene placebo + chemoterapia.
Dátum ukončenia databázy 15. 6. 2021.
Liek KEYTRUDA® je vhodný pre pacientov s lokálne rekurentným neresekovateľným alebo metastázujúcim trojnásobne negatívnym karcinómom prsníka s PD-L1 expresiou s CPS ≥ 101

Štúdia preukázala 34 % zníženie rizika progresie alebo úmrtia HR = 0,66; 95 % CI 0,50 – 0,88) u pacientov s nádormi exprimujúcimi PD-L1 s CPS ≥ 10 randomizovaných do liečebného ramena s liekom KEYTRUDA® v kombinácii s chemoterapiou v porovnaní s placebom v kombinácii s chemoterapiou.3

Medián PFS bol v ramene s liekom KEYTRUDA® + chemoterapia 9,7 mesiaca vs. 5,6 mesiaca v ramene s placebom + chemoterapia.3

Liečba liekom KEYTRUDA® + chemoterapia u pacientov s pokročilým TNBC s CPS ≥ 10 štatisticky významne predĺžila celkové prežívanie (OS) (HR = 0,73; 95 % CI: 0,55 – 0,95) vs. samotná chemoterapia: medián 23 mesiacov s liekom KEYTRUDA® + chemoterapia vs. medián 16,1 mesiaca s placebom + chemoterapia.3
Bezpečnosť liečby bola v súlade so známym bezpečnostným profilom a neobjavili sa žiadne nové bezpečnostné signály.3
Referencie:
1. Súhrn charakteristických vlastností lieku KEYTRUDA®
2. Cortes J et al. Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for previously untreated locally recurrent inoperable or
metastatic triple-negative breast cancer (KEYNOTE-355): a randomised, placebo-controlled, double-blind, phase 3 clinical trial. Lancet 2020;
396(10265):1817-1828.
3. Cortes J et al. Pembrolizumab plus Chemotherapy in Advanced Triple-Negative Breast Cancer. N Engl J Med. 2022;387(3):217-226.
4. Rugo HS et al. KEYNOTE-355: Final results from a randomized, double-blind, phase 3 study of first line pembrolizumab + chemotherapy versus
placebo chemotherapy for metastatic triple-negative breast cancer. Presented at ESMO 2021.
Výdaj lieku je viazaný na lekársky predpis. Pred predpísaním si prosím preštudujte Súhrn charakteristických vlastností lieku.
