KN-189
KN-189
Indikácia: KEYTRUDA® je v kombinácii s chemoterapiou obsahujúcou pemetrexed a platinu indikovaná ako liečba prvej línie metastatického neskvamózneho nemalobunkového karcinómu pľúc u dospelých bez pozitivity mutácií EGFR alebo ALK v nádorových bunkách.1
Indikačné obmedzenie platné od 1. júla 20242:
(kód I01329)
- Neskvamózny metastatický nemalobunkový karcinóm pľúc
- 1L kombinovaná liečba s chemoterapiou obsahujúcou pemetrexed a platinu
- Expresia PD-L1 s TPS < 50%
- Bez pozitivity v mutácií EGFR alebo ALK v nádorových bunkách
- ECOG: 0-1
- Liečba je hradená po dobu maximálne 24 mesiacov
- Hradená liečba podlieha predchádzajúcemu schváleniu zdravotnej poisťovne.
Dizajn klinickej štúdie KEYNOTE-1893:
Randomizovaná, multicentrická, dvojito zaslepená, placebom kontrolovaná klinická štúdia so študovanou populáciou 616 pacientov.
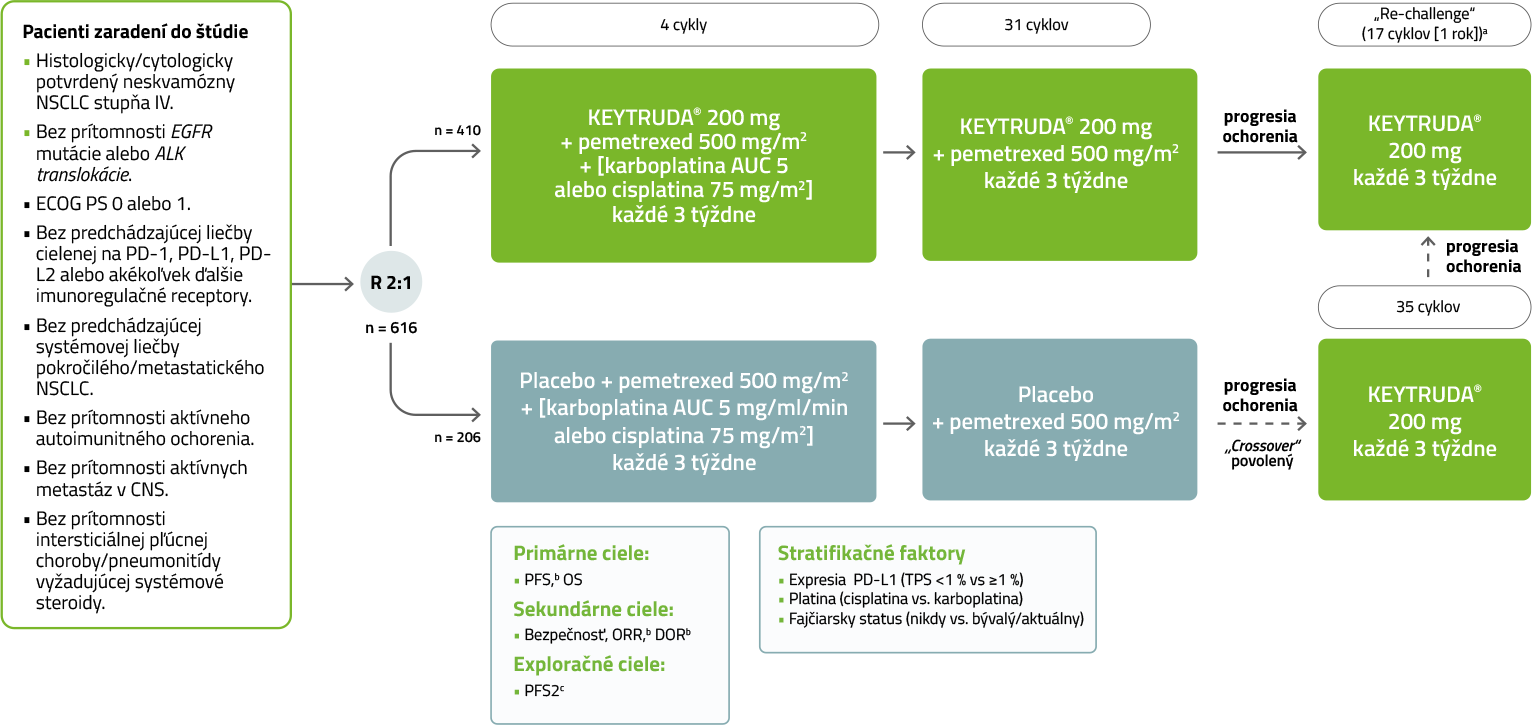
a Pacienti, ktorí po dokončení 35 cyklov pembrolizumabu mali SD alebo lepšiu alebo hodnotenú liečbu ukončili po dosiahnutí CR a dostali ≥ 8 cyklov liečby, ale potom sa u nich vyskytla PD, mohli dostávať druhú kúru pembrolizumab so 17 cyklami (približne 1 rok), pokiaľ od poslednej dávky pembrolizumabu nedostali žiadnu novú protirakovinovú liečbu
b Podľa RECIST v 1.1 hodnotenej BICR.
c PFS2 definované ako čas od randomizácie do skúšajúcim hodnotenej PD, ktorá viedla pri prerušení druholíniovej liečby, začatí tretej línie alebo úmrtí
Východiskové charakteristiky (populácia ITT)4
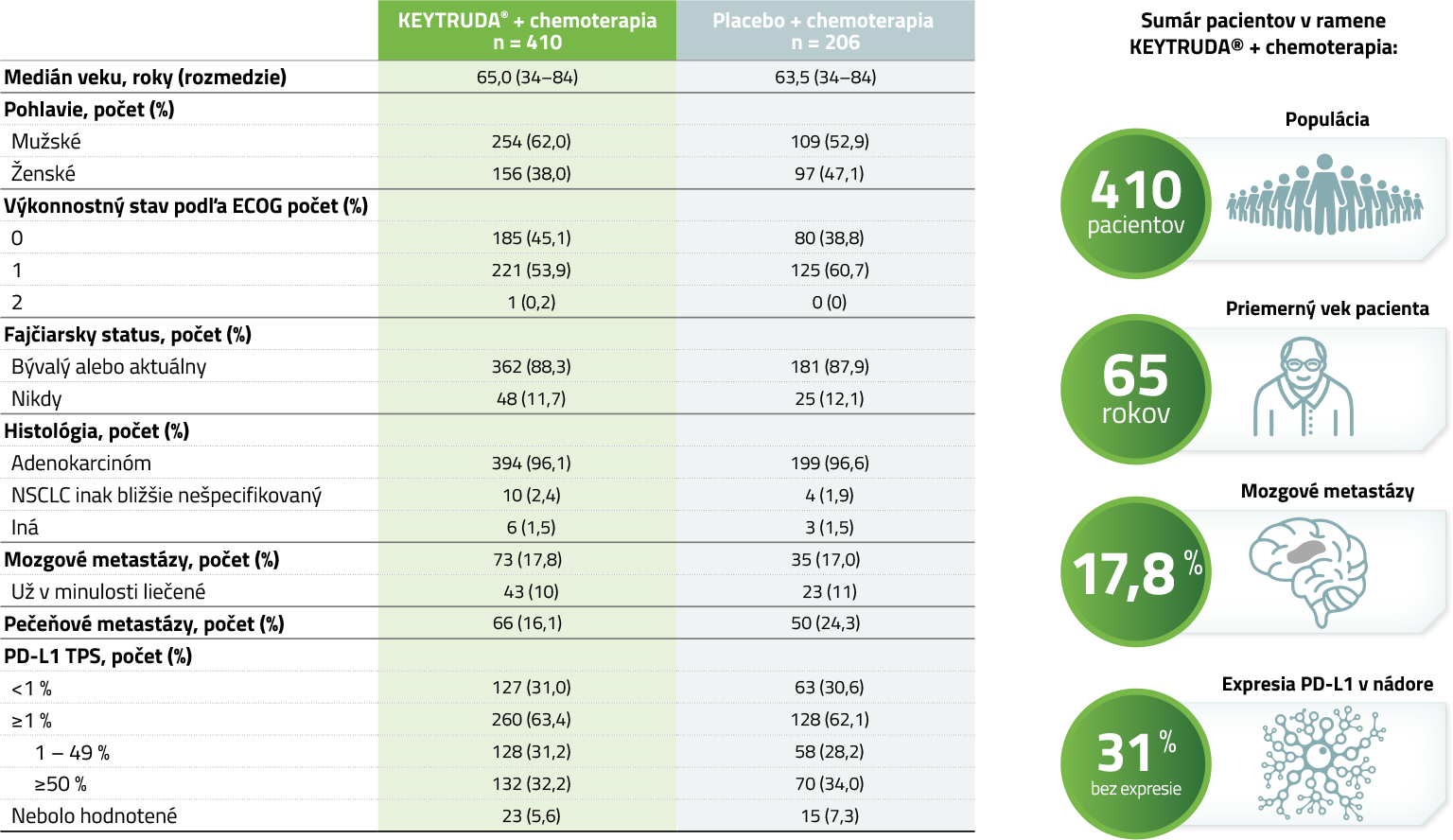
Uzávierka dát: 20. máj 2019.
Celkové prežívanie (OS) v populácii ITT5
Po 5 rokoch kombinovanej liečby KEYTRUDA + chemoterapia prežíva takmer 20 % pacientov.
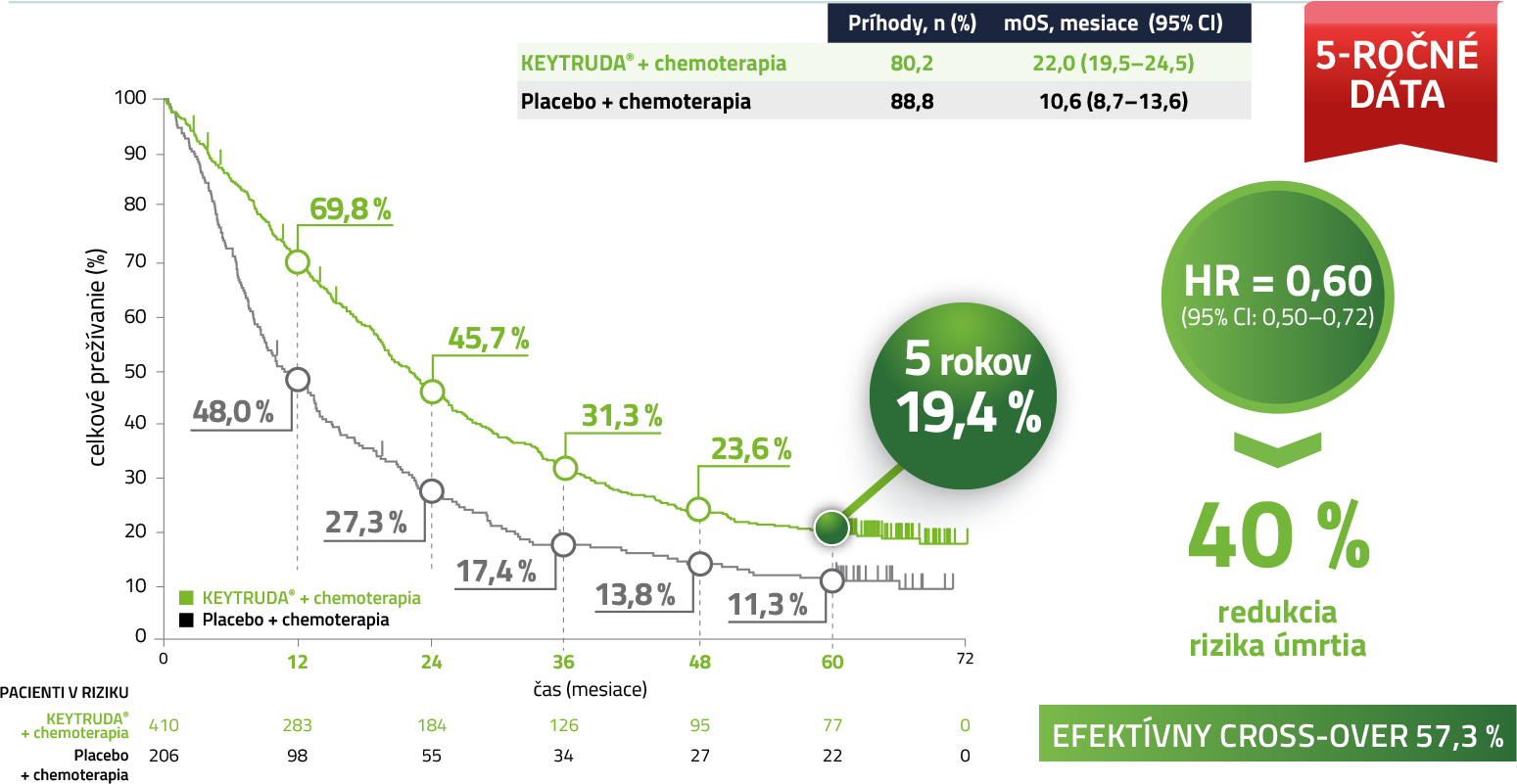
Medián sledovania = 64,6 mesiaca (rozmedzie: 60,1 – 72,4 mesiaca). Uzávierka dát: 8. marec 2022.
Kaplan-Meierov odhad
Kaplan-Meierov odhad celkového prežívania u pacientov s PD-L1 expresiou (TPS < 1 %)5,a
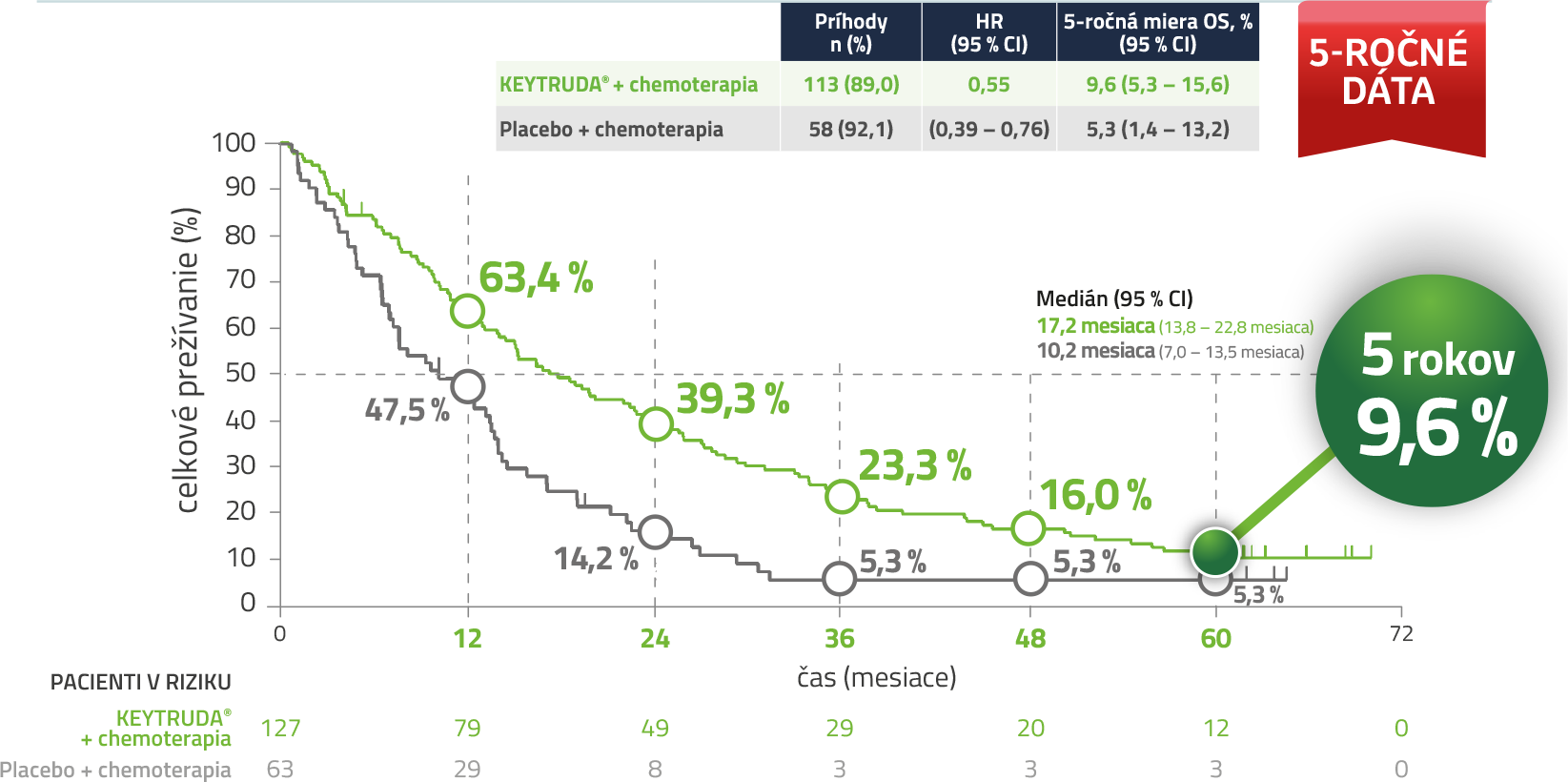
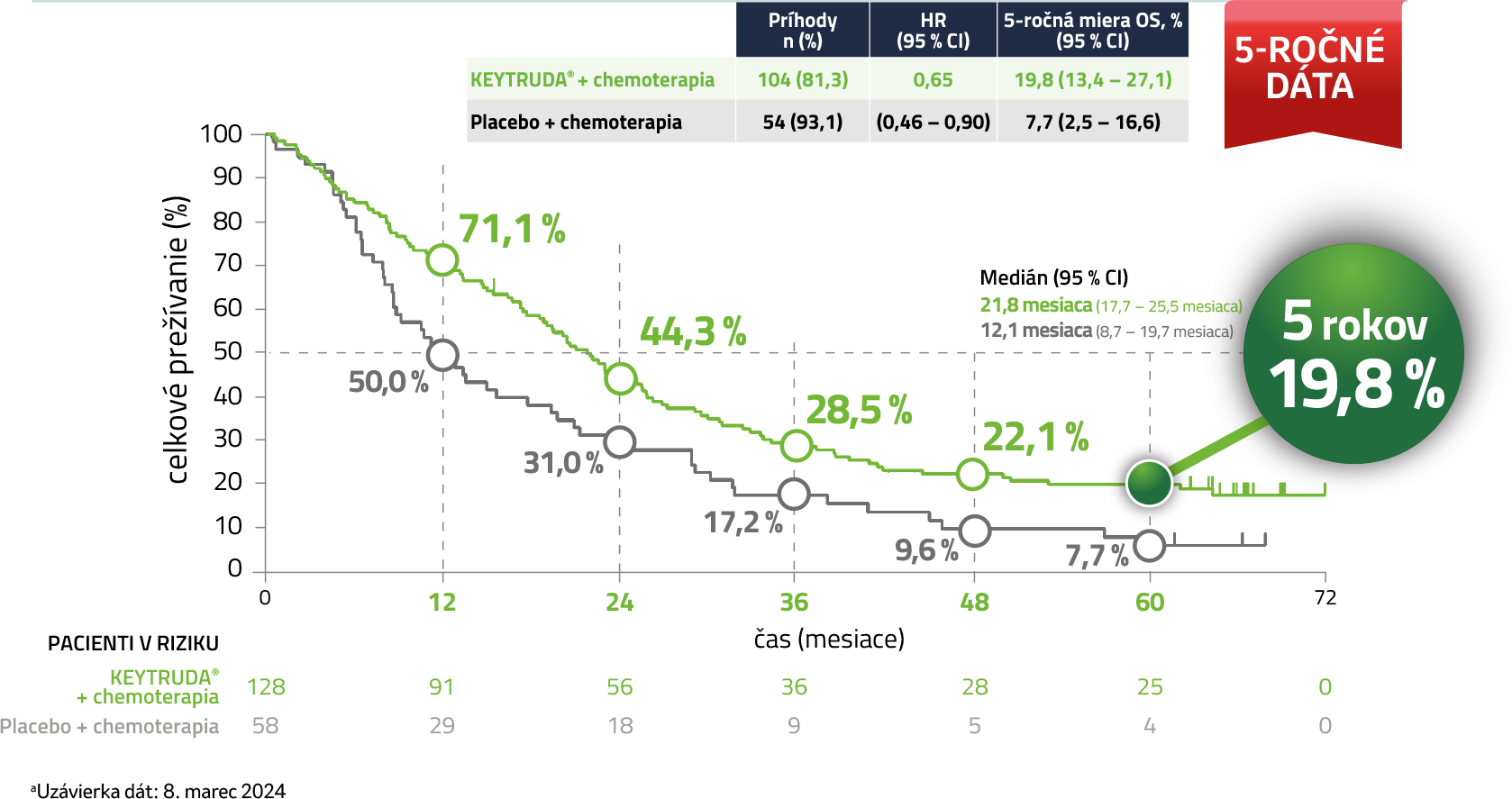
a Uzávierka dát: 8. marec 2024
Kaplan-Meierov odhad celkového prežívania u pacientov s PD-L1 expresiou (TPS 1 – 49 %)5,a
Kaplan-Meierov odhad celkového prežívania u pacientov s PD-L1 expresiou (TPS ≥ 50 %)5,a
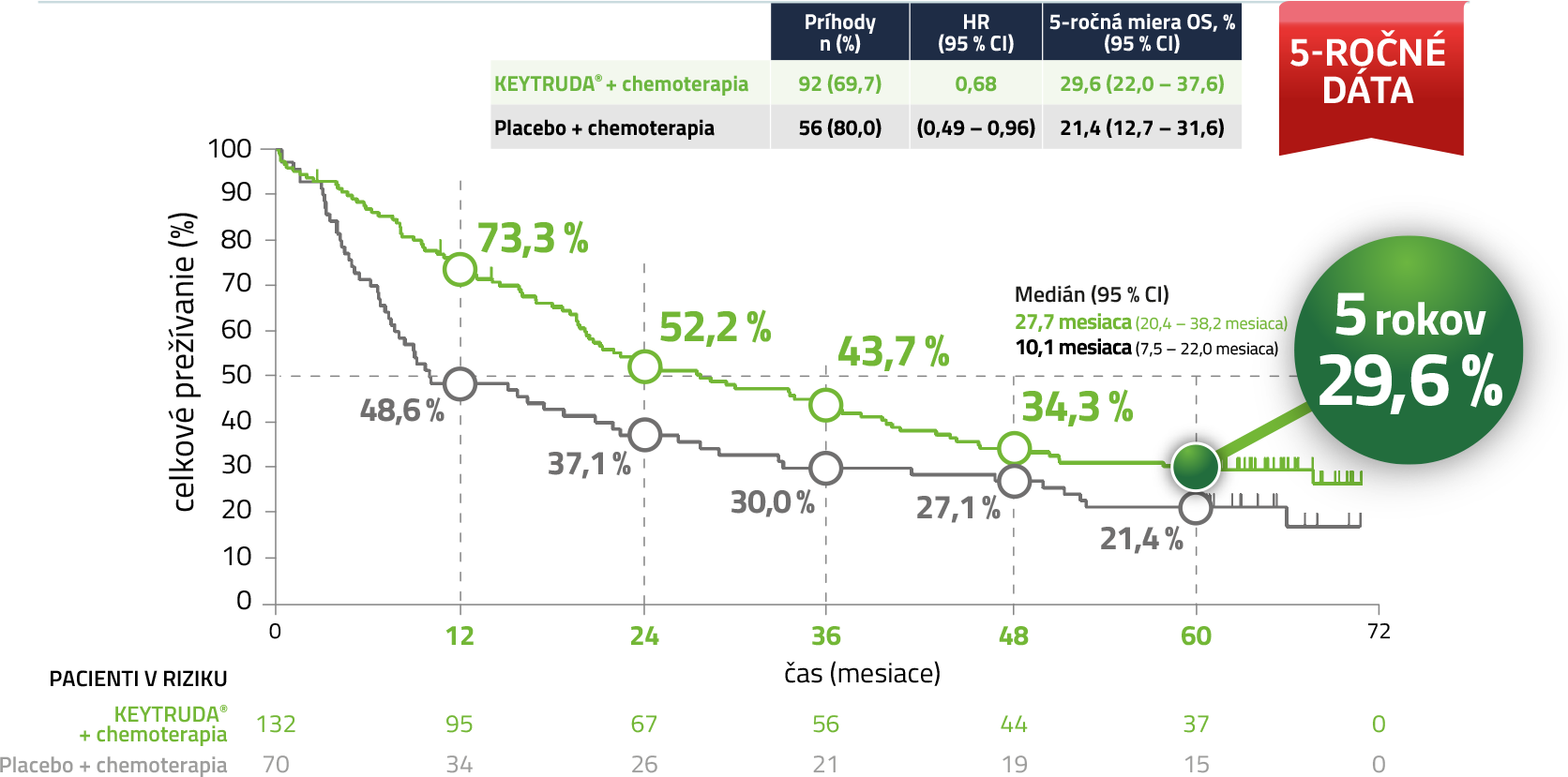
a Uzávierka dát: 8. marec 2024
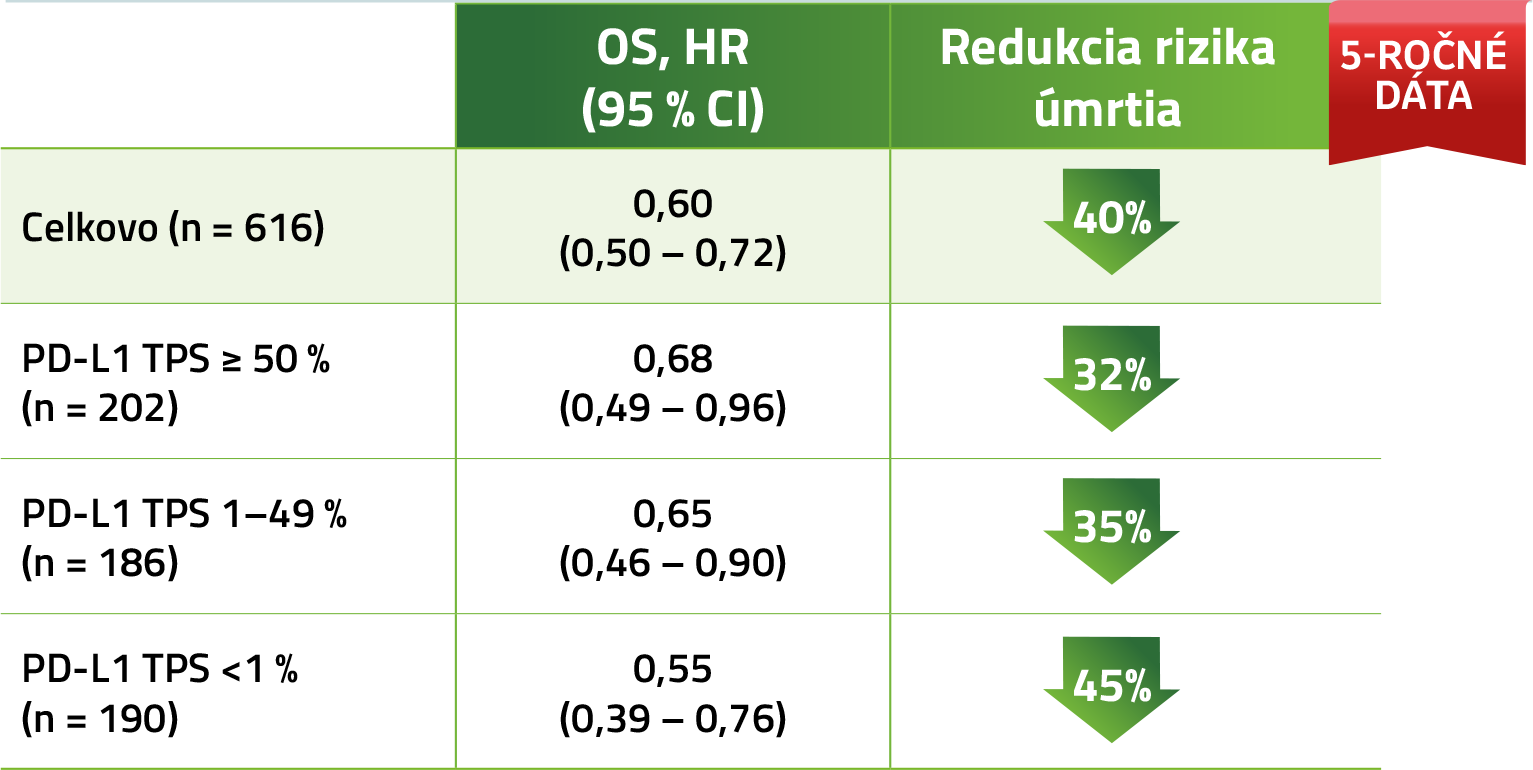
Celkové prežívanie (OS) v populácii ITT5
Podskupiny podľa PD-L1 TPS expresie.
PFSa v populácii ITT5
V 5-ročnej aktualizovanej exploračnej analýze u pacientov s neskvamóznym NSCLC sa pri liečbe kombináciou KEYTRUDA + chemoterapia pozoroval dlhší čas do progresie ochorenia v porovnaní so skupinou liečenou placebom + chemoterapiou.
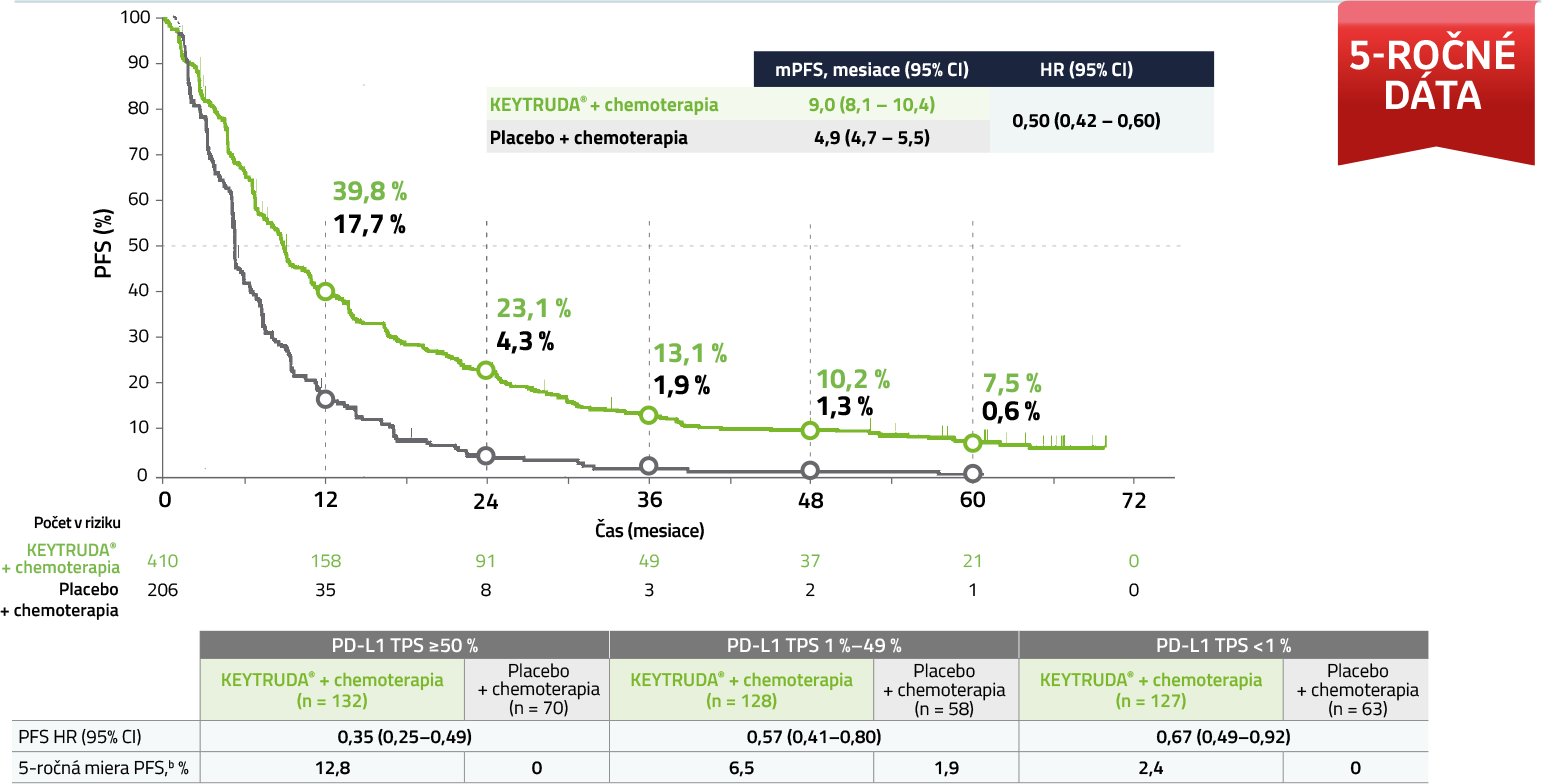
Medián sledovania = 64,6 mesiaca (rozmedzie: 60,1 – 72,4 mesiaca). Uzávierka dát: 8. marec 2022.
a Podľa RECIST v. 1.1 hodnotenej BICR.
b Kaplan-Meierov odhad.
ORR a DORa v populácii ITT5
V 5-ročnej aktualizovanej exploračnej analýze u pacientov s neskvamóznym NSCLC sa v ramene KEYTRUDA® + chemoterapia pozorovalo vyššie ORR a dlhšie mDOR vs. placebo + chemoterapia.

Medián sledovania = 64,6 mesiaca (rozmedzie: 60,1 – 72,4 mesiaca). Uzávierka dát: 8. marec 2022.
a Podľa RECIST v1.1 hodnotené BICR.
b Kaplan-Meierov odhad; „+“ ukazuje žiadnu PD pri poslednom hodnotení choroby.
ORRa a OS u pacientov, ktorí dokončili 35 cyklov liečby liekom KEYTRUDA®5
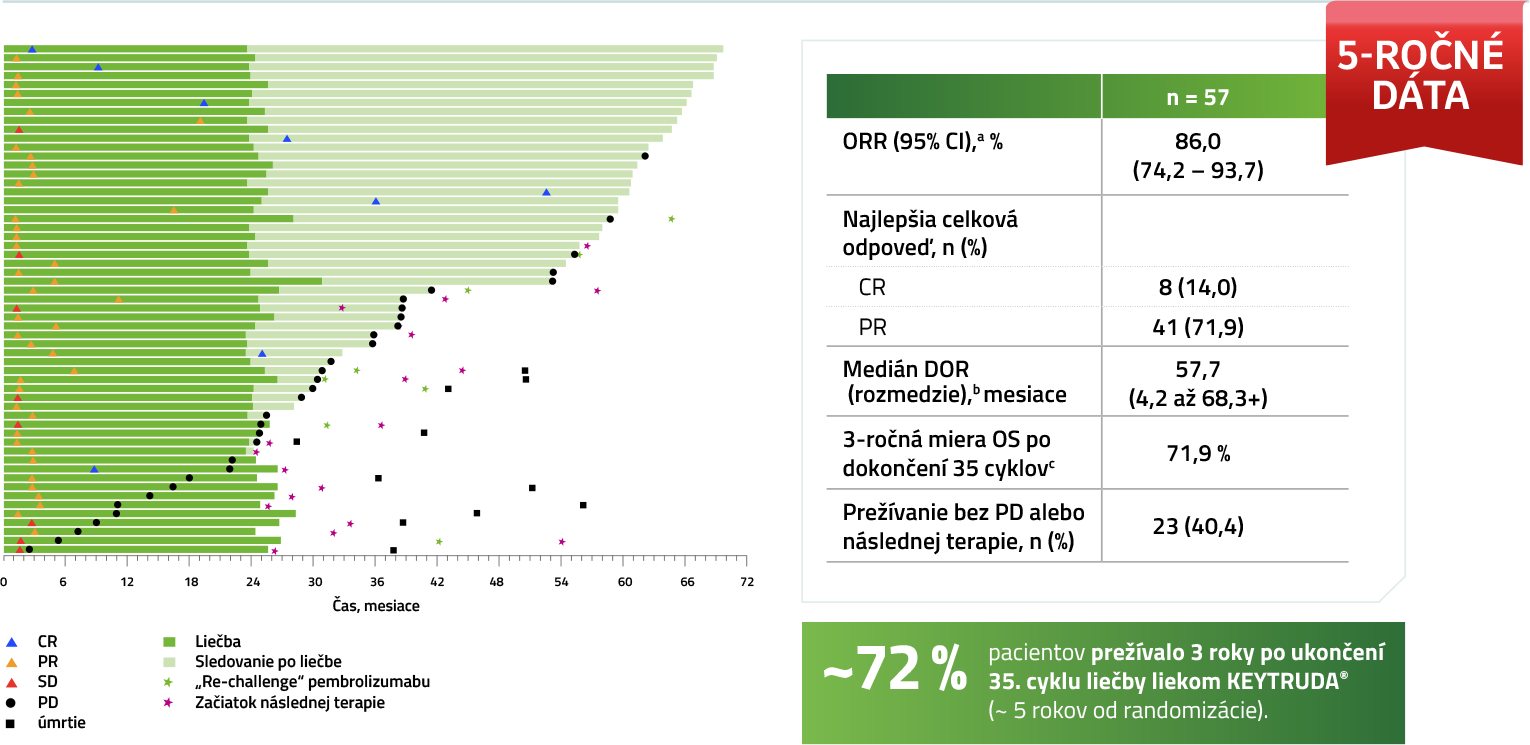
Medián sledovania = 64,6 mesiaca (rozmedzie: 60,1 – 72,4 mesiaca). Uzávierka dát: 8. marec 2022.
a Podľa RECIST v1.1 hodnotené BICR.
b Kaplan-Meierov odhad.
c Približne 5 rokov po randomizácii.
PFS u pacientov bez PD-L1 expresie (TPS < 1%)5
V 5-ročnej aktualizovanej exploračnej analýze u pacientov s neskvamóznym NSCLC bez expresie PD-L1 v nádore sa pozorovalo zlepšenie PFS v ramene KEYTRUDA® + chemoterapia vs. placebo + chemoterapia.

Exploračná analýza následného sledovania
Medián sledovania = 64,6 mesiaca (rozmedzie: 60,1 – 72,4 mesiaca). Uzávierka dát: 8. marec 2022.
a Kaplan-Meierov odhad
ORR a DOR u pacientov bez PD-L1 expresie (TPS<1%)5
V 5-ročnej aktualizovanej exploračnej analýze u pacientov s neskvamóznym NSCLC bez expresie PD-L1 v nádore sa v ramene KEYTRUDA® pozorovalo vyššie ORR a dlhšie mDOR vs. placebo + chemoterapia.
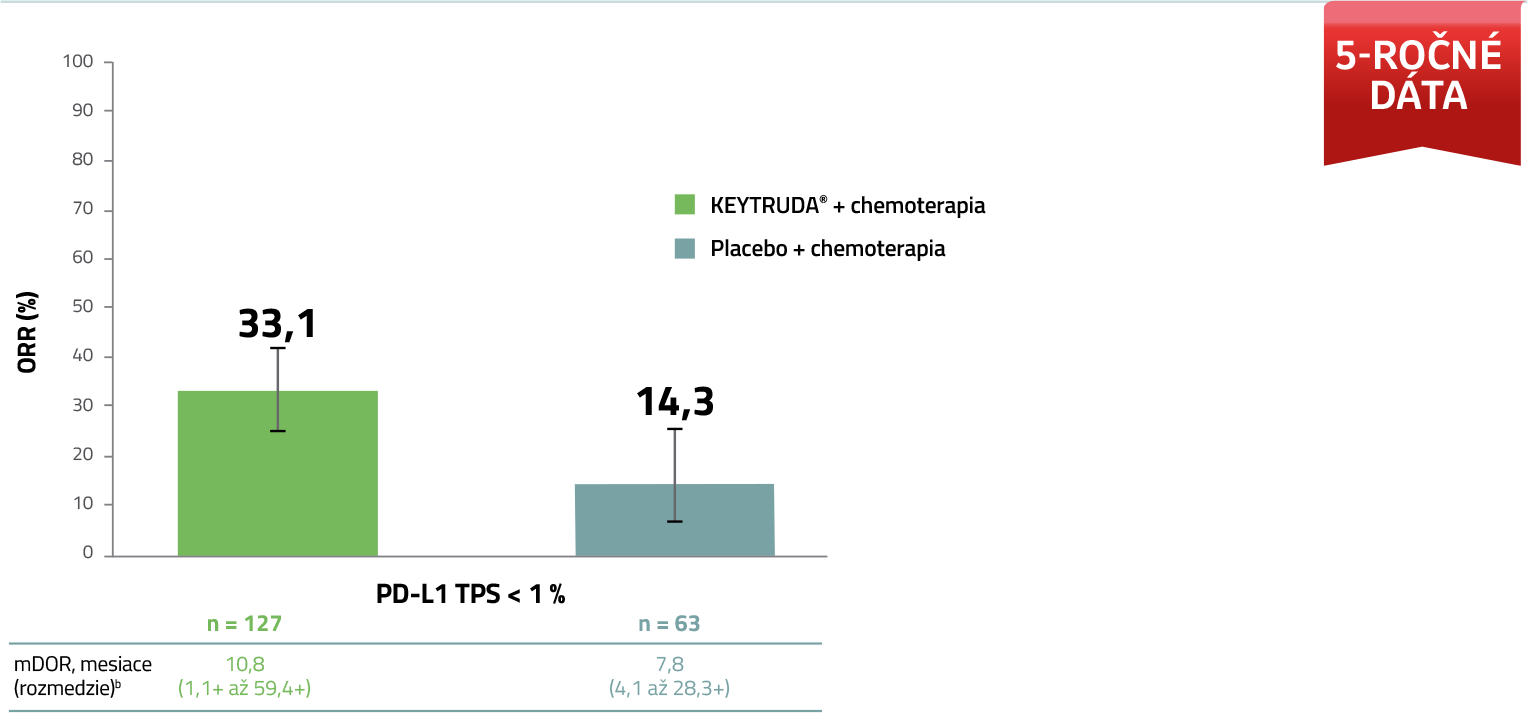
Exploračná analýza následného sledovania
Medián sledovania = 64,6 mesiaca (rozmedzie: 60,1 – 72,4 mesiaca). Uzávierka dát: 8. marec 2022.
a Podľa RECIST v. 1.1 hodnotené BICR.
b Kaplan-Meierov odhad; „+“ ukazuje žiadnu PD v čase posledného vyšetrenia choroby.
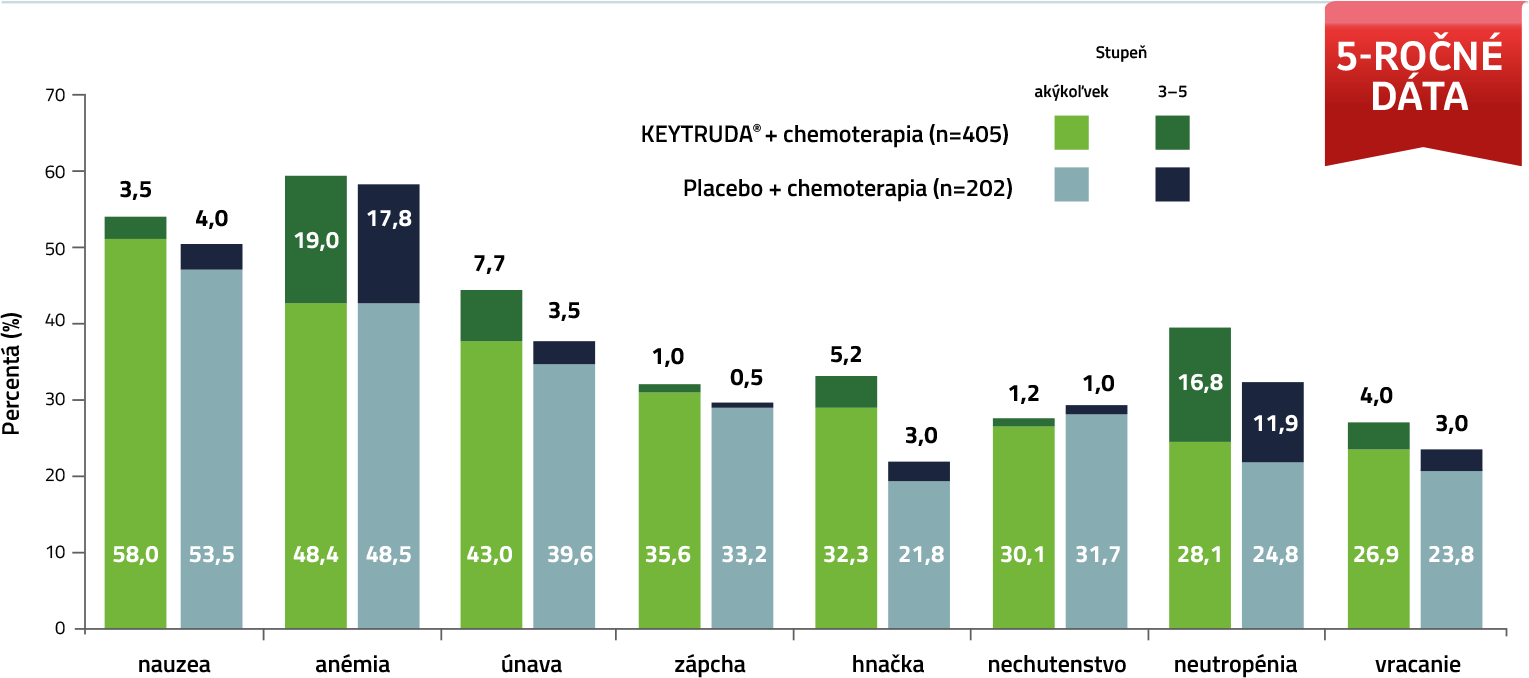
Prehľad nežiaducich reakcií5
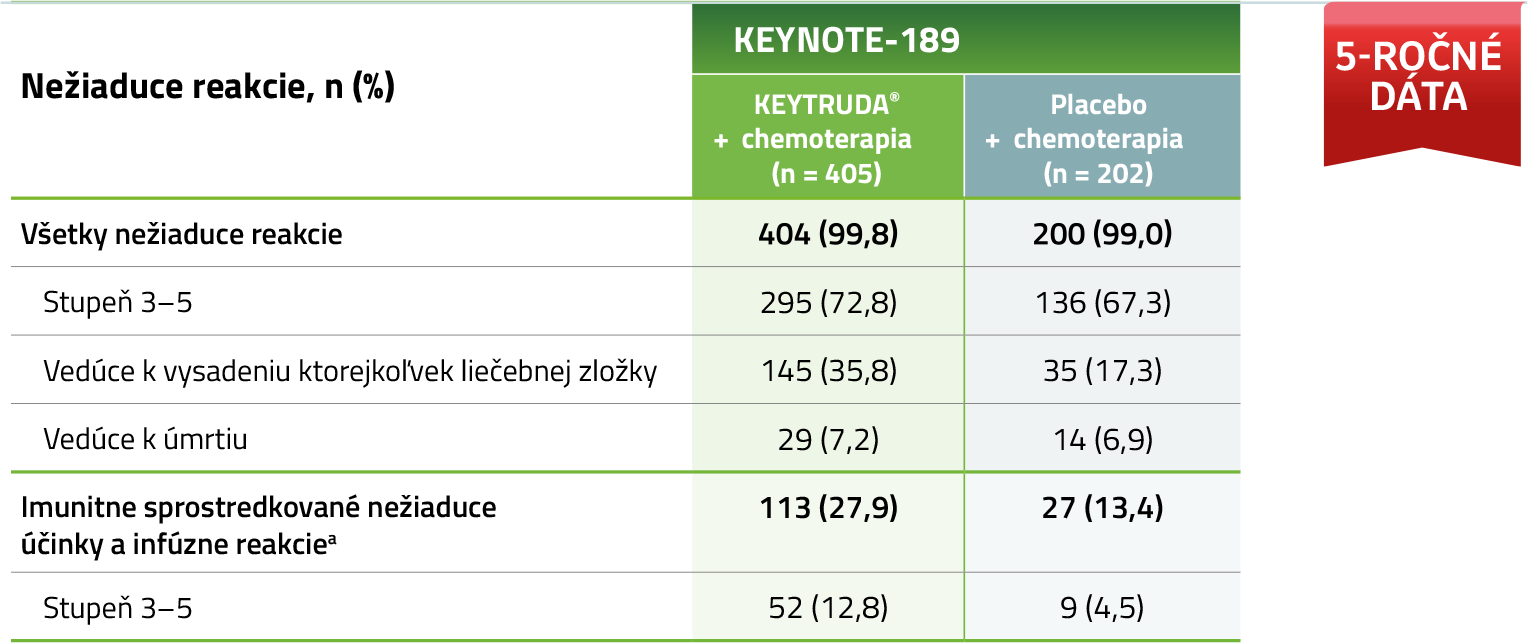
Pri 5-ročnom sledovaní sa nepozorovali žiadne nové bezpečnostné signály oproti primárnej analýze.
a Bez ohľadu na priradenú liečbu a súvislosť s imunitou podľa názoru skúšajúceho.
Najčastejšie nežiaduce reakcie (≥ 26%)5
Klinické štúdie pre metastatický nemalobunkový karcinóm pľuc:
Referencie:
1. Súhrn charakteristických vlastností lieku KEYTRUDA®
2. Rozhodnutie Ministerstva zdravotníctva Slovenskej republiky
3. Gandhi L et al. N Engl J Med. 2018;378(22):2078–2092.
4. Rodríguez-Abreu D et al. Ann Oncol. 2021;32(7):881–895.
5. Garassino MC, et al. J Clin Oncol. 2023;JCO2201989. doi:10.1200/JCO.22.01989.
Výdaj lieku je viazaný na lekársky predpis. Pred predpísaním si prosím preštudujte Súhrn charakteristických vlastností lieku.