KN-522
KN-522
Indikácia: KEYTRUDA je v kombinácii s chemoterapiou indikovaná ako neoadjuvantná liečba a následne s pokračovaním vo forme monoterapie ako adjuvantná liečba po chirurgickom zákroku dospelým s lokálne pokročilým trojnásobne negatívnym karcinómom prsníka alebo trojnásobne negatívnym karcinómom prsníka alebo trojnásobne negatívnym karcinómom prsníka v skorom štádiu s vysokým rizikom rekurencie (pozri časť 5.1 SPC).1,2
Dizajn štúdie KEYNOTE-5223,4
Randomizované, multicentrické, dvojito zaslepené, placebom kontrolované klinické hodnotenie u 1 174 pacientov.

a Randomizácia bola stratifikovaná podľa stavu lymfatických uzlín (pozitívne v. negatívne), veľkosti nádoru (T1/T2 v.T3/T4) a výberu dávkovania karboplatiny (každé tri týždne vs. každý týždeň).
b Všetka študijná medikácia bola podávaná intravenózne.
AUC = plocha pod krivkou; EFS = prežitie bez príhody; pCR = patologická kompletná odpoveď; PD-L1 = ligand receptora programovanej bunkovej smrti 1; R = randomizácia;TNBC = trojnásobne negatívny karcinóm prsníka.
Vstupné charakteristiky pacientov v ITT populácii3,4,*

* Uvedené údaje vychádzajú z populácie so zámerom liečiť (ITT). Z dôvodu zaokrúhľovania a chýbajúcich dát nemusí byť súčet percentuálnych hodnôt rovný 100. ULN znamená hornú hranicu normálneho rozmedzia.
a Pozitivita ligandu receptora programovanej smrti 1 (PD-L1) bola definovaná ako kombinované pozitívne skóre 1 alebo vyššie. Kombinované pozitívne skóre PD-L1 bolo definované ako počet PD-L1-pozitívnych buniek (nádorové bunky, lymfocyty a makrofágy) delený celkovým počtom nádorových buniek a vynásobený 100.
b Skóre výkonnostného stavu podľa Eastern Cooperative Oncology Group (ECOG) nadobúda hodnoty od 0 do 5, pričom 0 znamená neprítomnosť žiadnych príznakov a vyššie skóre znamená väčšiu disabilitu.
c Nádory s expresiou receptora pre ľudský epidermálny rastový faktor 2 (HER2) rovnou 0 alebo 1 podľa imunohistochemickej analýzy boli negatívne. Všetky nádory s expresiou HER2 2+ podľa imunohistochemickej analýzy boli negatívne pre amplifikáciu HER2 in situ hybridizáciou.
ECOG = Eastern Cooperative Oncology Group; HER2 = ľudský epidermálny rastový faktor 2; PD-L1 = ligand receptora programovanej bunkovej smrti 1; ULN = horná hranica normálu.
KEYTRUDA®: Dávkovanie a liečebné režimy v KEYNOTE-5223, 4
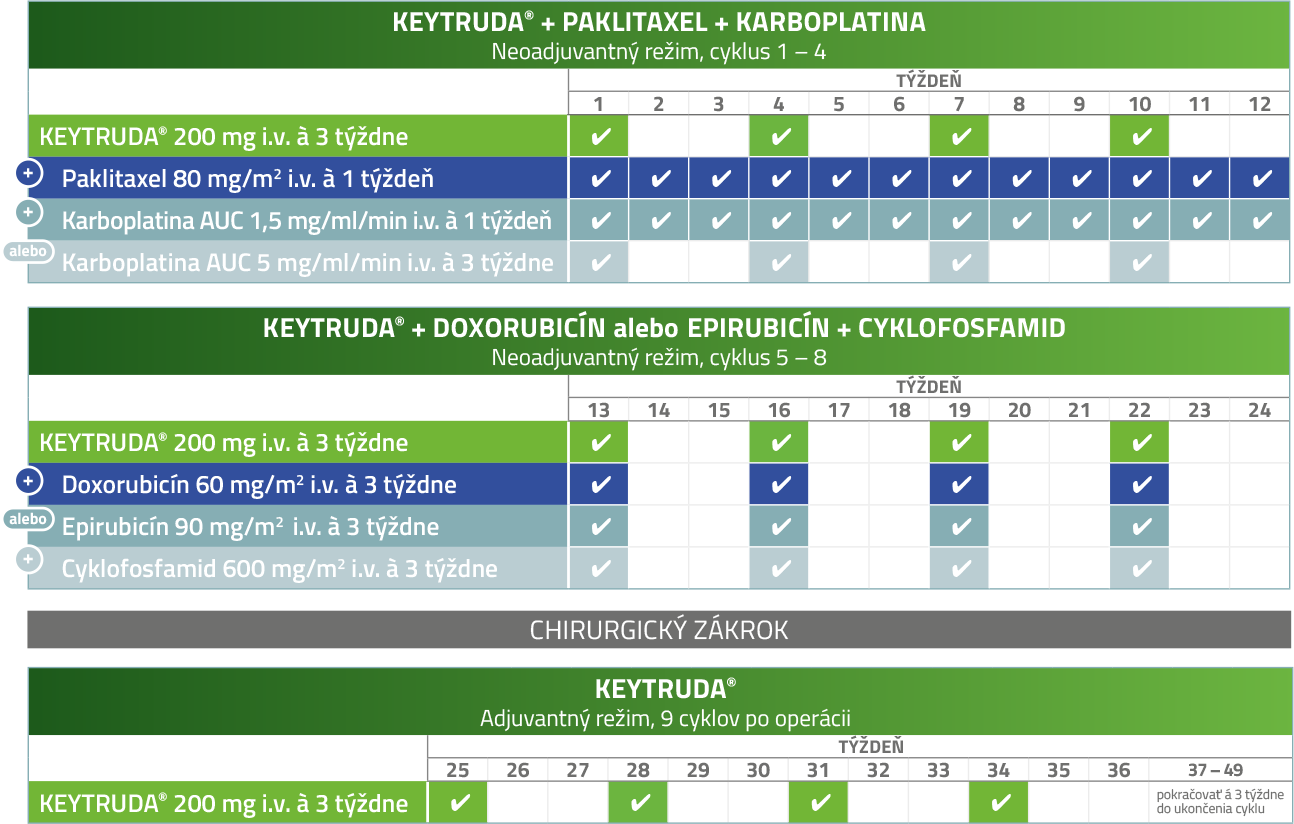
Podávanie lieku KEYTRUDA® v štúdii KEYNOTE-5223
U pacientov liečených v skorom štádiu TNBC kombináciou lieku KEYTRUDA + chemoterapia v neoadjuvancii a následne liekom KEYTRUDA v monoterapii v adjuvancii bolo v štúdii KN-522 preukázané štatisticky signifikantné zlepšenie prežívania bez udalostí (EFS).3

Prežívanie bez udalostí (EFS) bolo definované ako čas od randomizácie do prvého výskytu ktorejkoľvek z nasledujúcich udalostí: progresia ochorenia, ktoré vylučuje chirurgický zákrok, lokálna alebo vzdialená rekurencia, druhá primárna malignita alebo úmrtie z akejkoľvek príčiny.3
U pacientov liečených v skorom štádiu TNBC kombináciou lieku KEYTRUDA® + chemoterapia v neoadjuvancii a následne liekom KEYTRUDA® v monoterapii v adjuvancii, liečba naďalej vykazovala klinicky významné zlepšenie EFS aj po 5 rokoch, bez ohľadu na výsledok miery pCR7,8,*
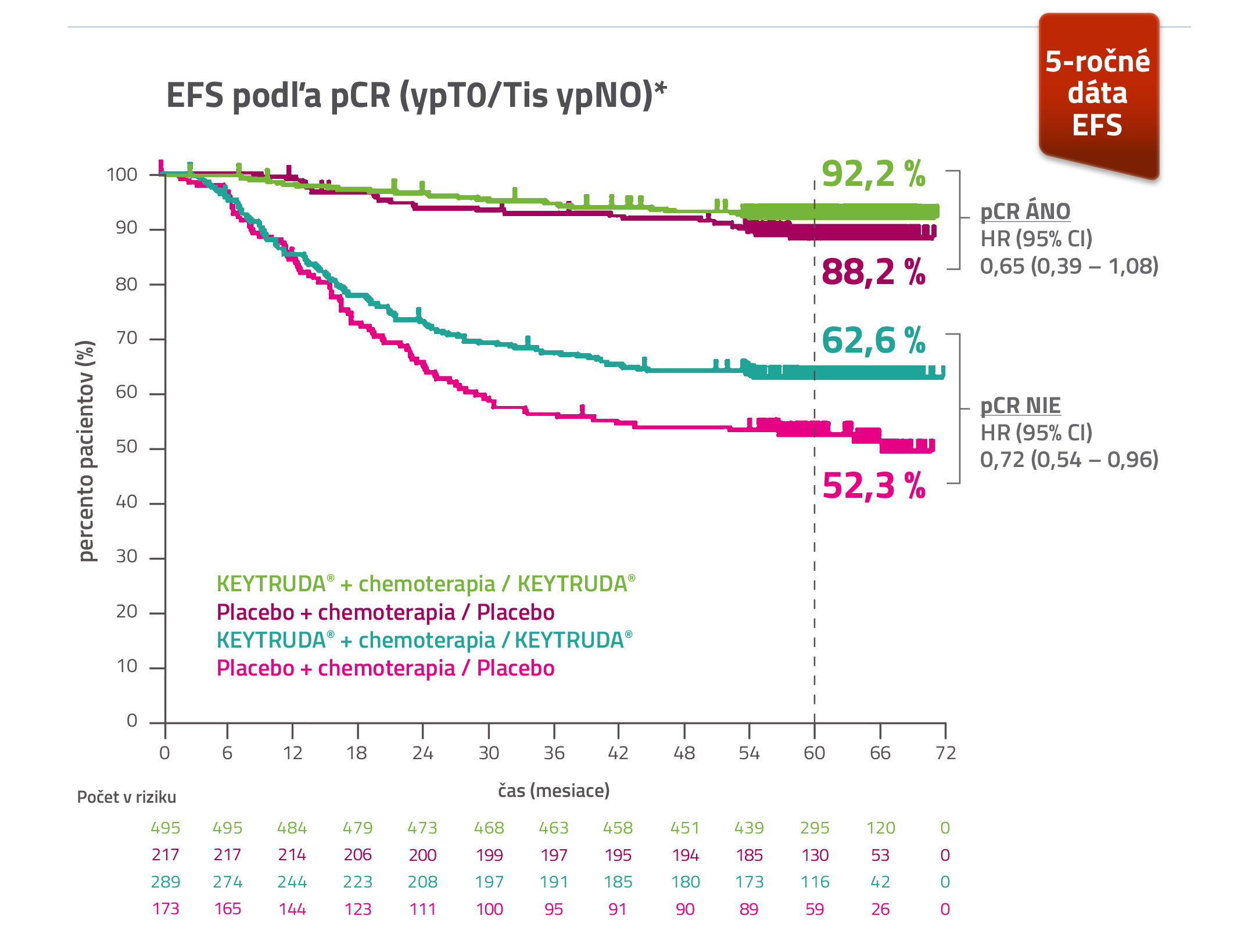
EFSa podľa pCR v protokolom preddefinovanej, šiestej priebežnej analýze pacientov liečených kombináciou KEYTRUDA® + chemoterapiab / KEYTRUDA® vs. placebo + chemoterapiab/placebo.7,8,*
Medián sledovaniac: 63,1 mesiaca (53,9 – 72,0)
* LIMITÁCIA: V protokolom špecifikovanej analýze prežívania bez udalosti (event-free survival, EFS), nebolo plánované žiadne formálne štatistické testovanie, a preto z nej nie je možné vyvodiť jasné závery.
a Šiesta priebežná analýza EFS sa začala ~ 72 mesiacov od randomizácie prvého pacienta. 7,8
b Karboplatina/paklitaxel nasledovaný AC alebo EC. 7,8
c Definované ako čas od randomizácie do dátumu cut-off 23. marca 2023.7
EFS = prežívanie bez udalosti, pCR =patologická kompletná odpoveď
Dátum uzávierky: marec 2023.
U pacientov liečených v skorom štádiu TNBC kombináciou lieku KEYTRUDA® + chemoterapia v neoadjuvancii a následne liekom KEYTRUDA® v monoterapii v adjuvancii, liečba naďalej vykazovala klinicky významné zlepšenie EFS aj po 5 rokoch, bez ohľadu na expresiu PD-L1 7,8,*

EFSa v protokolom vopred špecifikovanej, šiestej priebežnej analýze pre pacientov liečených kombináciou KEYTRUDA® + chemoterapiab/KEYTRUDA® vs. placebo + chemoterapiab/placebo.6,7,*
Medián sledovaniac: 63,1 mesiaca (53,9 – 72,0)
* LIMITÁCIA: V protokolom špecifikovanej analýze prežívania bez udalosti (event-free survival, EFS) nebolo plánované žiadne formálne štatistické testovanie, a preto z nej nie je možné vyvodiť jasné závery.
a Šiesta priebežná analýza EFS sa začala ~ 72 mesiacov od randomizácie prvého pacienta.7
b Karboplatina/paklitaxel nasledovaný AC alebo EC.7
c Definované ako čas od randomizácie do dátumu cut-off 23. marca 2023.7
d Na základe Coxovho regresného modelu a Efronovej metódy s liečbou ako premennou, stratifikovanou podľa stavu lymfatických uzlín, veľkosti nádoru a voľby dávkovania karboplatiny.
EFS = prežívanie bez udalosti, pCR =patologická kompletná odpoveď
Benefit EFS pri liečbe pembrolizumabom sa pozoroval vo všetkých preddefinovaných podskupinách aj po 5 rokoch.7,8

- Benefit prežívania bez udalosti (EFS) pri liečbe pembrolizumabom bol konzistentný vo všetkých preddefinovaných podskupinách nezávisle od expresie PD-L1 a stavu uzlín aj po 5 rokoch.8
- V preddefinovanej skupine, nerandomizovanej, exploratívnej analýzy bola 5-ročná miera EFS v skupine pacientov s pCR liečených pembrolizumabom vs. placebom 92,2 % oproti 88,2 % a u pacientov bez pCR liečených pembrolizumabom vs. placebom 62,6 % oproti 52,3 %.8
- Sledovanie celkového prežívania (OS) prebieha.8
EFS = prežívanie bez udalosti, pCR = patologická kompletná odpoveď, OS = celkové prežívanie
Pacienti profitovali z liečby naprieč všetkými podskupinami.3
KEYNOTE-522: Analýza prežívania bez udalostí v podskupinách3
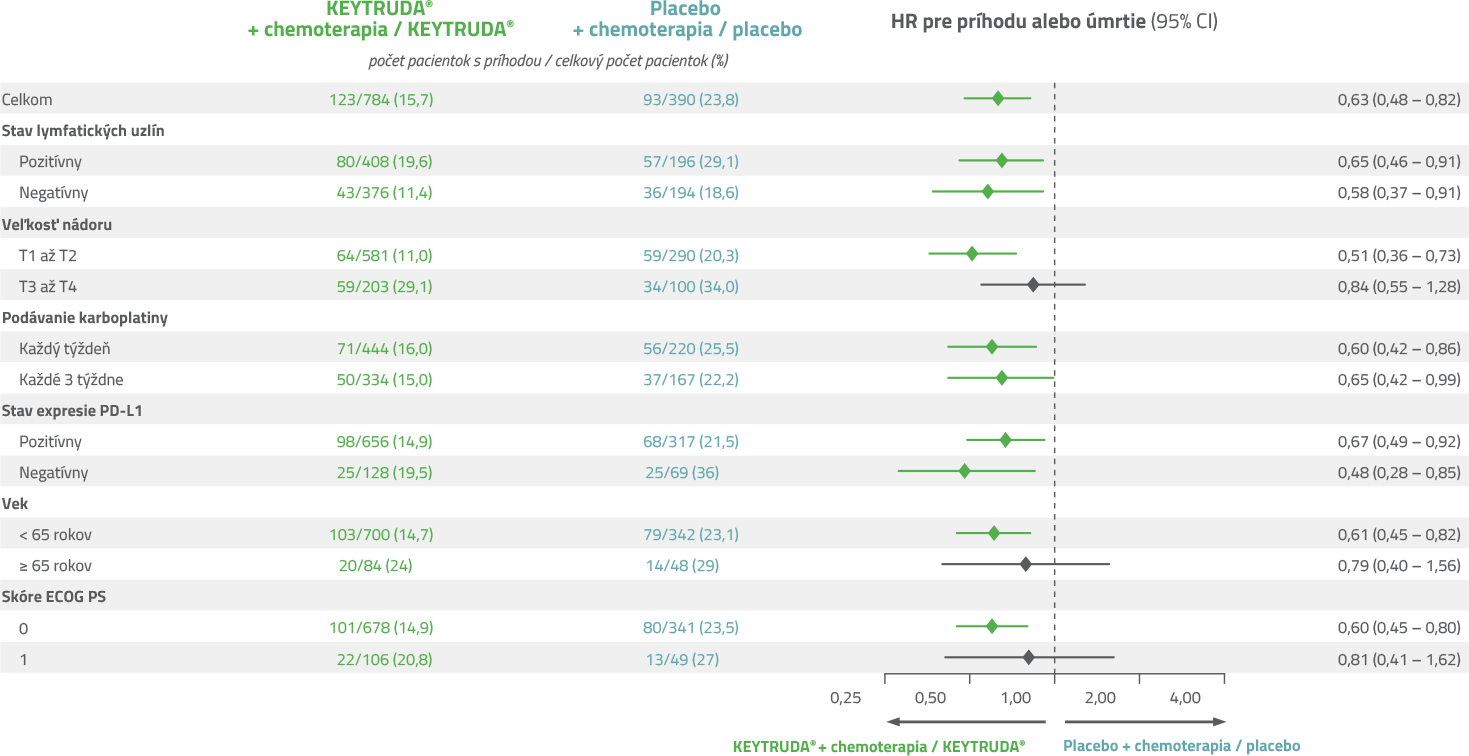
CI = interval spoľahlivosti; ECOG PS = výkonnostný stav podľa Eastern Cooperative Oncology Group; HR = pomer rizík; PD-L1 = ligand receptora programovanej bunkovej smrti 1.
Dátum uzamknutia databázy: 23. marca 2021
Nežiaduce reakcie súvisiace s liečbou v kombinovaných fázach liečby3
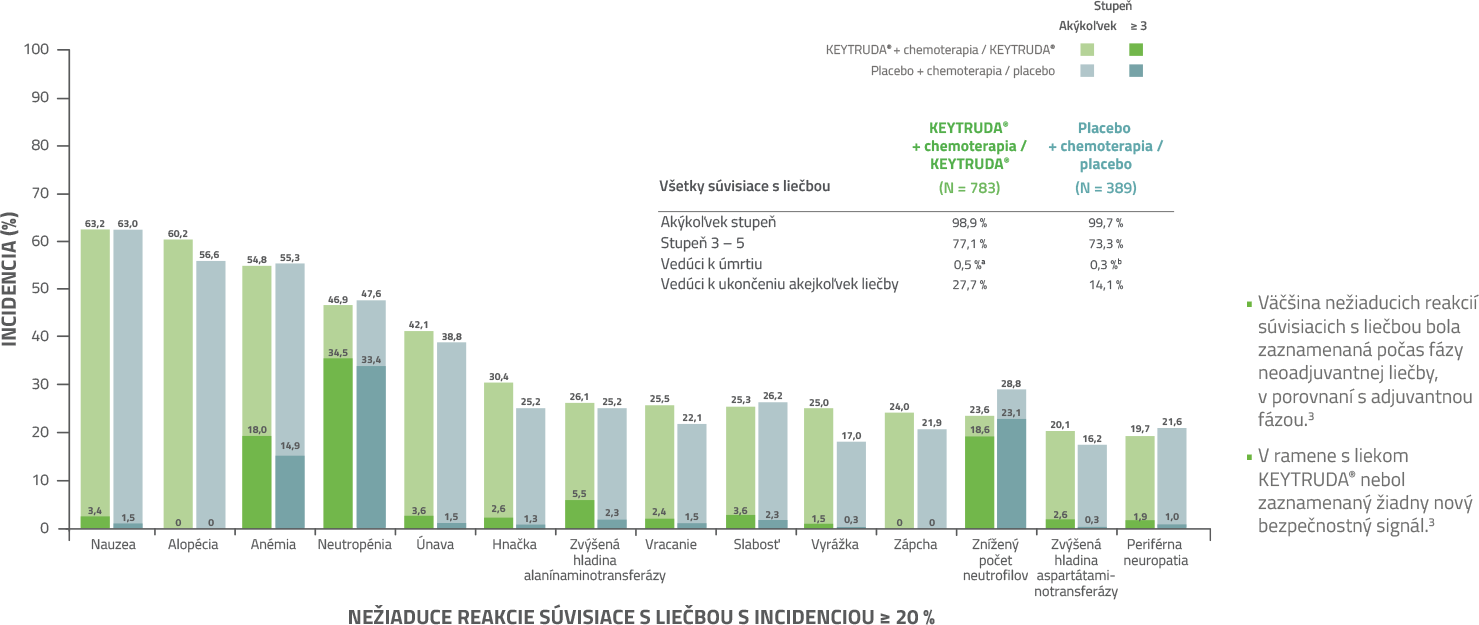
a 1 pacient zomrel na sepsu a syndróm multiorgánového zlyhania, 1 pacientka na pneumonitídu, 1 pacientka na pľúcnu embóliu a 1 pacientka na autoimunitnú encefalitídu.
b 1 pacient zomrel na septický šok.
AEs = Adverse events
Dátum uzamknutia databázy: 23. marca 2021
KEYNOTE-522: Imunitne sprostredkované nežiaduce reakcie počas adjuvantnej a neoadjuvantnej fázy liečby3
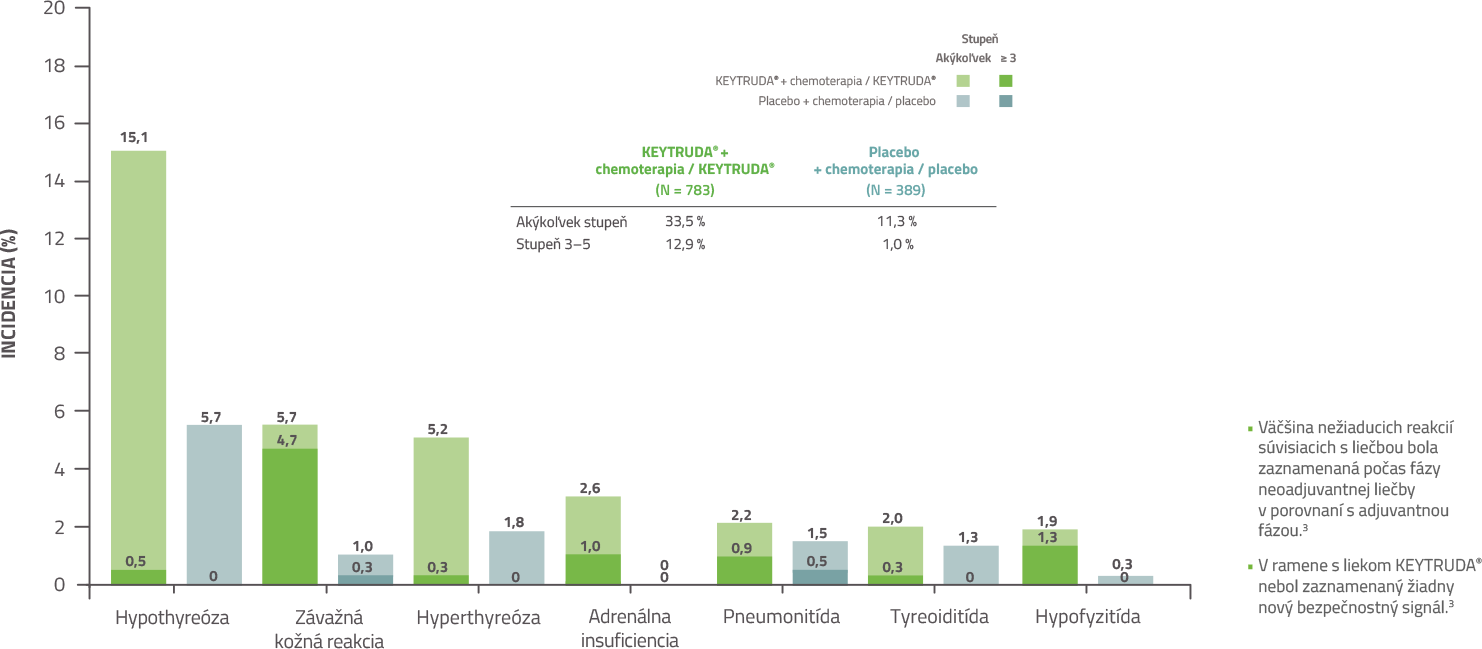
Dátum uzamknutia databázy: 23. marca 2021
KEYNOTE-522: Imunitne sprostredkované nežiaduce reakcie počas adjuvantnej fázy liečby3
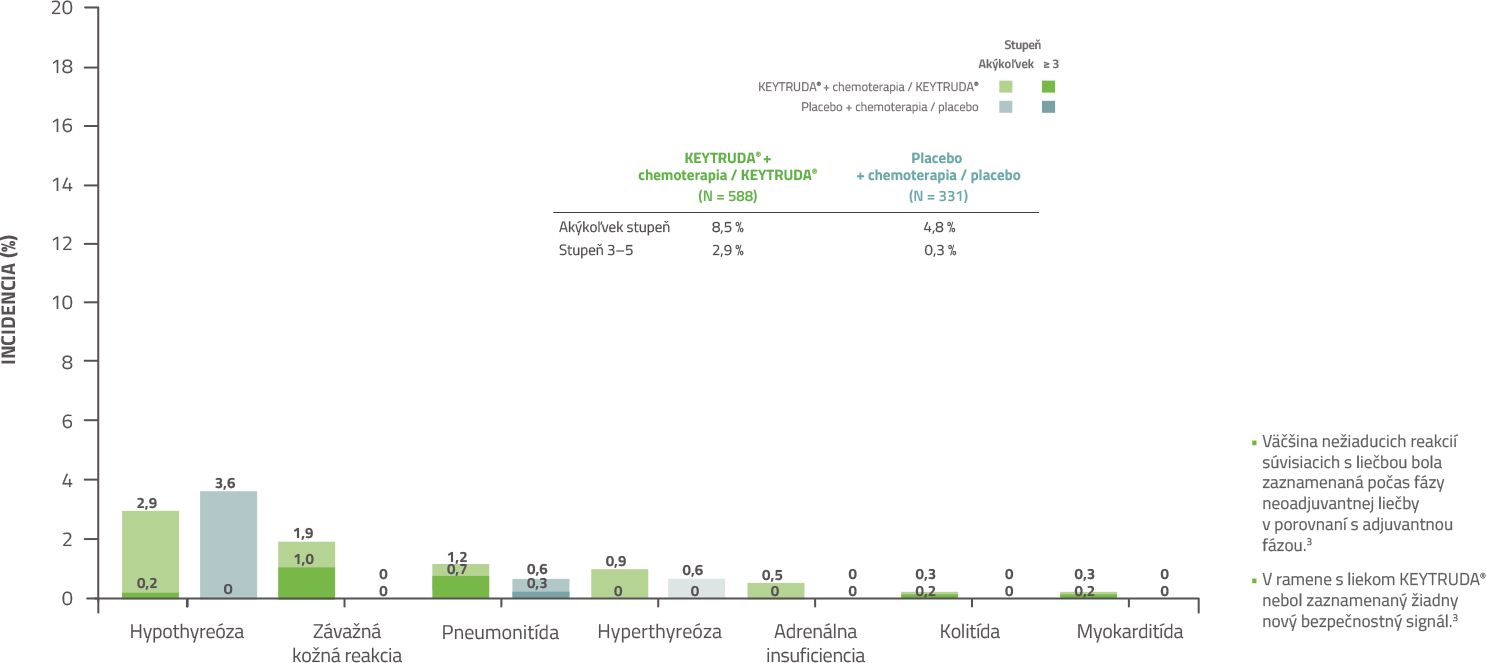
Dátum uzamknutia databázy: 23. marca 2021
KEYTRUDA®: Imunoterapia s kuratívnym potenciálom pre vašich pacientov s lokálne pokročilým trojnásobne negatívnym karcinómom prsníka alebo trojnásobne negatívnym karcinómom prsníka v skorom štádiu s vysokým rizikom rekurencie.1

64,8 % pacientov v skorom štádiu TNBC v štúdii KEYNOTE-522 liečených liekom KEYTRUDA® + chemoterapia v neoadjuvancii dosiahlo kompletnú patologickú odpoveď pri mediáne sledovania 15,5 mesiaca.4,*

U pacientov liečených v skorom štádiu TNBC kombináciou lieku KEYTRUDA® + chemoterapia v neoadjuvancii a následne liekom KEYTRUDA® v monoterapii v adjuvancii sa preukázalo konzistentné štatisticky významné zlepšenie prežívania bez udalosti alebo úmrtia (EFS) o 37 % po 36 mesiacoch aj po 5 rokoch BEZ OHĽADU NA EXPRESIU PD-L1. 3,8,#
Väčšina nežiaducich reakcií súvisiacich s liečbou a imunitne sprostredkovaných nežiaducich reakcií bola zaznamenaná počas fázy neoadjuvantnej liečby v porovnaní s adjuvantnou fázou liečby. Bezpečnostný profil bol konzistentný s už známymi profilmi jednotlivých režimov.3
* Dáta z prvej interim analýzy u prvých 602 pacientov, ktorí podstúpili randomizáciu.
# Odhadované prežívanie bez udalosti po 36 mesiacoch.
Päťročné dáta: medián sledovania 63,1 mesiaca – cut off 23. marca 2023.
Referencie:
1. Súhrn charakteristických vlastností lieku KEYTRUDA®
2. Zoznam kategorizovaných liekov Časť B: Indikačné obmedzenia
3. Schmid P et al. Event-free survival with pembrolizumab in early triple-negative breast cancer. NEJM 2022;386:556-67.
4. Schmid P et al. Pembrolizumab for early triple-negative breast cancer. NEJM 2020;382:810-21.
5. Ministerstvo Zdravotníctva Slovenskej republiky – Skríning rakoviny prsníka
6. NCI SEER Program. Cancer stats facts: female breast cancer subtypes. Accessed May 16, 2022.
7. Schmid P, Cortez J, Dent R, et al.Pembrolizumab or placebo + chemotherapy followed by pembrolizumab or placebo for early-stage triple-negative breast cancer: updated event-free survival results from the phase 3 KEYNOTE-522 study. Slide deck presented at: European Society for Medical Oncology; October 20, 2023; Madrid, Spain.
8. Schmidt et al. Pembrolizumab or placebo plus chemotherapy followed by pembrolizumab or placebo for early-stage TNBC: Updated EFS results from the phase III KEYNOTE-522 study; Annals of Oncology, Abstracts, LBA18, Volume 34, Issue S2, 2023: page S 1257; https://doi.org/10.1016/j. annonc.2023.10.008
Výdaj lieku je viazaný na lekársky predpis. Pred predpísaním si prosím preštudujte Súhrn charakteristických vlastností lieku.
