KN-024
KN-024
Indikácia: KEYTRUDA je v monoterapii indikovaná ako liečba prvej línie metastatického nemalobunkového karcinómu pľúc u dospelých s expresiou PD-L1 v nádoroch, s proporčným skóre nádoru (tumour proportion score, TPS) ≥ 50 %, bez pozitivity mutácií EGFR alebo ALK v nádorových bunkách.1
Znenie indikačného obmedzenia2:
(kód I00729)
- v monoterapii indikovaná ako liečba prvej línie metastatického nemalobunkového karcinómu pľúc u dospelých s expresiou PD-L1 v nádoroch, s proporčným skóre nádoru (tumour proportion score, TPS) ≥ 50 %, bez pozitivity mutácií EGFR alebo ALK v nádorových bunkách, maximálne po dobu 24 mesiacov
- Hradená liečba podlieha predchádzajúcemu schváleniu zdravotnej poisťovne.
Dizajn štúdie KEYNOTE-0243,4,5
Randomizovaná, otvorená, multicentrická, kontrolovaná štúdia fázy 3, ktorá zahŕňala nepredliečených pacientov s metastatickým NSCLC, ktorých nádory vykazovali vysokú expresiu PD-L1 (TPS ≥ 50 %). Zo štúdie boli vyradení pacienti s genómovými aberáciami EGFR alebo ALK v nádore; autoimunitným ochorením, ktoré vyžadovalo systémovú liečbu počas dvoch rokov liečby; zdravotným stavom, ktorý vyžadoval imunosupresiu; alebo ktorí absolvovali ožiarenie hrudníka počas predchádzajúcich 26 týždňov v dávke viac ako 30 Gy. Pacienti boli randomizovaní (1:1) na podávanie pembrolizumabu v dávke 200 mg každé 3 týždne (n = 154) alebo chemoterapie obsahujúcej platinu podľa výberu skúšajúceho (n = 151; zahŕňajúcej pemetrexed +karboplatina, pemetrexed+cisplatina, gemcitabín+cisplatina, gemcitabín+karboplatina alebo paklitaxel+karboplatina; pacienti s neskvamóznym NSCLC mohli dostávať udržiavaciu liečbu pemetrexedom). Primárnym ukazovateľom účinnosti bolo PFS. Sekundárnymi ukazovateľmi účinnosti boli OS a ORR. Pacienti dostávajúci chemoterapiu, u ktorých sa objavila nezávisle potvrdená progresia ochorenia, mali umožnený prechod na liečbu KEYTRUDOU. Pacienti boli liečení KEYTRUDOU do neakceptovateľnej toxicity alebo progresie ochorenia. Ak bol pacient klinicky stabilizovaný a skúšajúci zhodnotil, že liečba preňho predstavuje klinický prínos, liečba mohla pokračovať aj po progresii ochorenia. Pacienti bez progresie ochorenia mohli byť liečení až do 24 mesiacov.
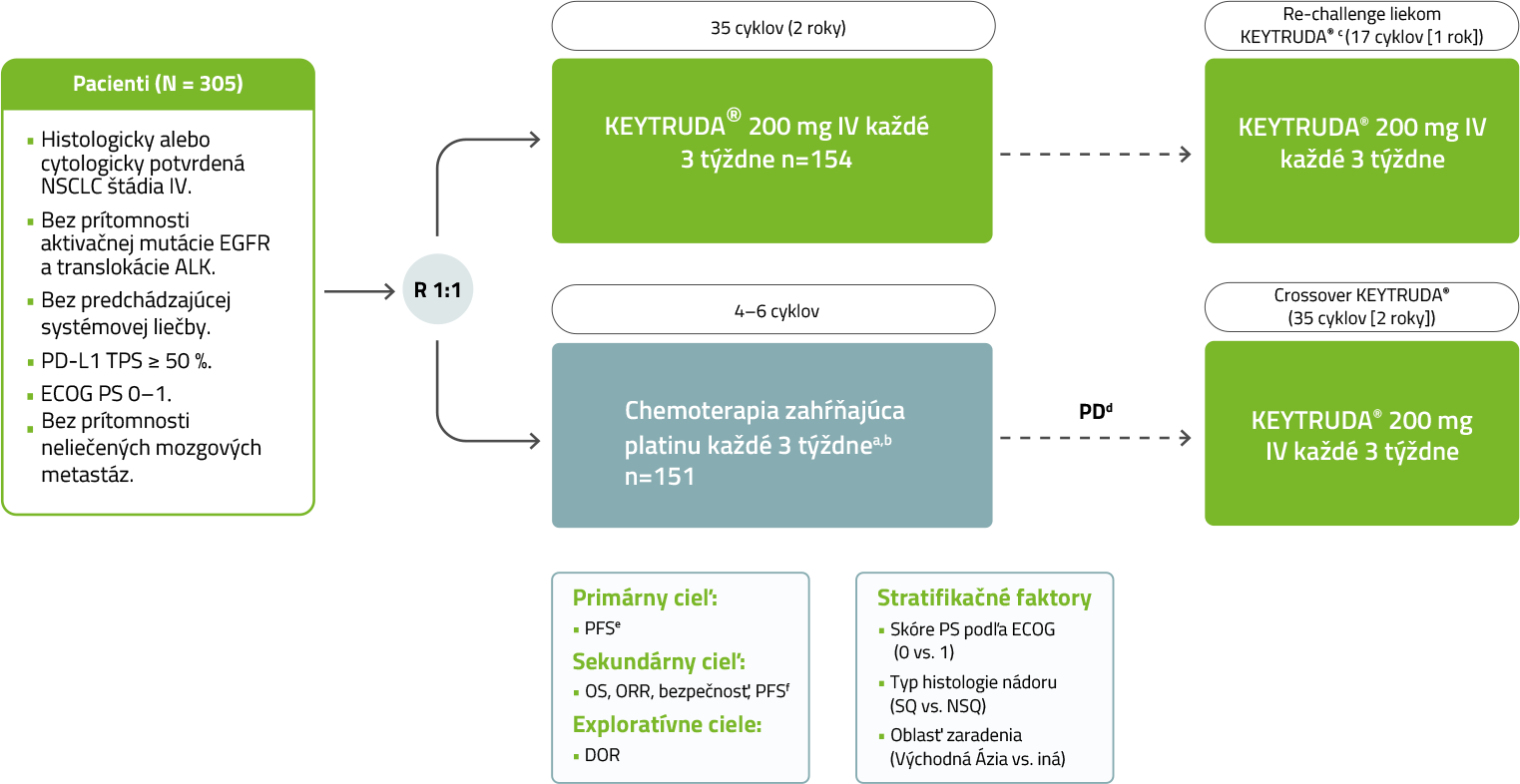
a Pemetrexed 500 mg/m2 + karboplatina AUC 5 až 6 (povolené iba pri NSQ ochoreníí), pemetrexed 500 mg/m2 + cisplatina 75 mg/m2 (povolené iba pri NSQ ochoreníí), paklitaxel 200 mg/m2 + karboplatina AUC 5 až 6, gemcitabin 1 250 mg/m2 + karboplatina AUC 5 až 6 alebo gemcitabin 1 250 mg/m2 + cisplatina 75 mg/m2.
b Voliteľná udržovacia liečba pemetrexedem NSQ ochorenia.
c Pre zaradenie do druhej fázy liekom KEYTRUDA® v monoterapii boli vhodní pacienti randomizovaní do skupiny liečených liekom KEYTRUDA®, ktorí dokončili 2 roky liečby alebo ktorý liek KEYTRUDA® vysadili po dosiahnutí CR a následne malii PD.
d Pred doporučením DMC a 8. dodatkom, ktoré povolili, aby pacientom liečených v ramene s chemoterapiou bol ponúknutý liek KEYTRUDA® (na základe údajov z 2. predbežnej analýzy), boli pacienti vhodní k prekríženiu, keď PD potvrdila BICR.
e Podľa RECIST v1.1 dle BICR.
f Podľa RECIST v1.1 skúšajúcim.
Vstupné charakteristiky populácie
(populácia intention-to-treat (ITT))4,5
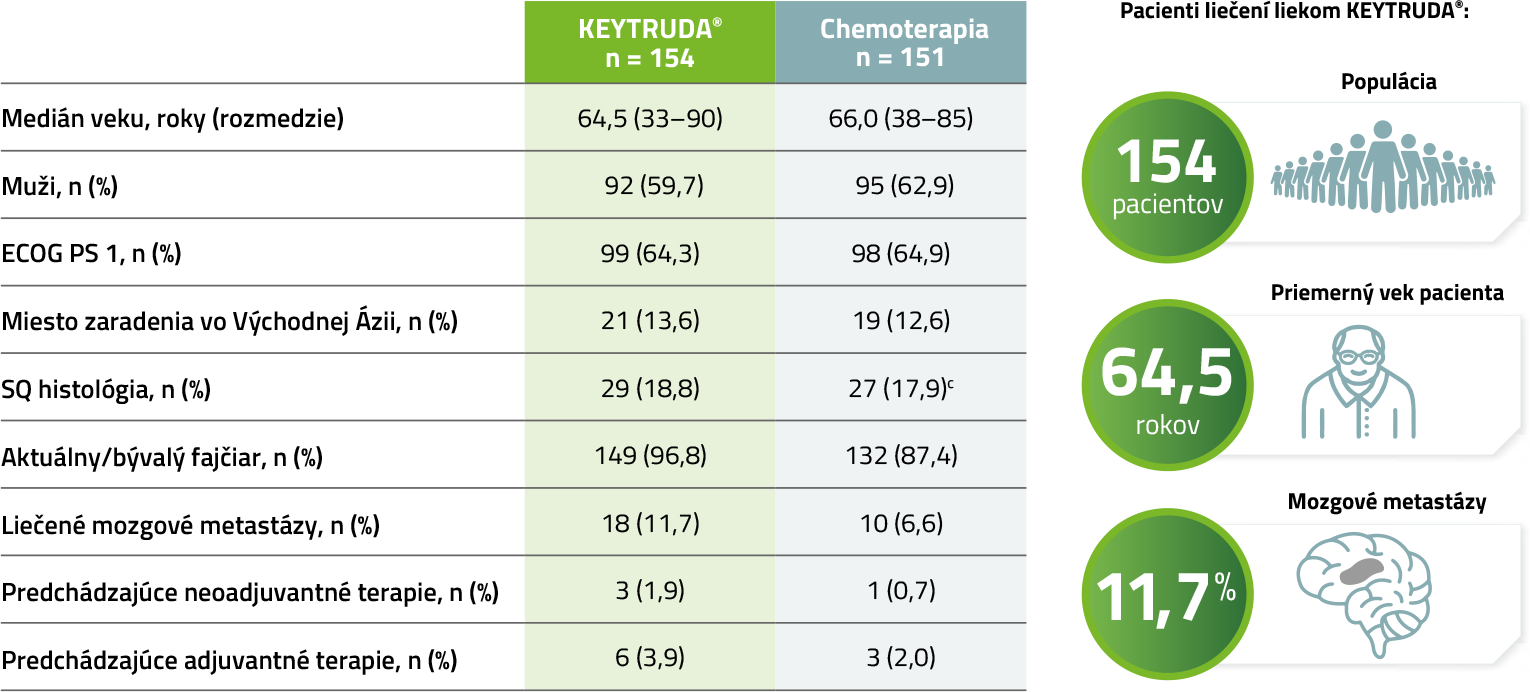
Uzávierka dát 1. jún 2020.
a Zahŕňa iba tých pacientov, ktorí boli od začiatku alokovaní na liečbu liekom KEYTRUDA®, ktorí dostali 35 cyklov (2 roky) liekom KEYTRUDA® podľa vyhodnotenia skutočnej expozície.
b Zahŕňa iba tých pacientov, ktorí boli odzačiatku alokovaní na liečbu liekom KEYTRUDA®, ktorí dostali druhý cyklus lieku KEYTRUDA® podľa vyhodnotenia skutočnej expozície.
c Zahŕňa pacientov s SQ bunkovým karcinómom a zle diferencovaným SQ bunkovým karcinómom.
Celkové prežívanie (OS) v populácii ITT4,5
Po 5 rokoch sledovania je nažive takmer 1/3 pacientov liečených liekom KEYTRUDA®
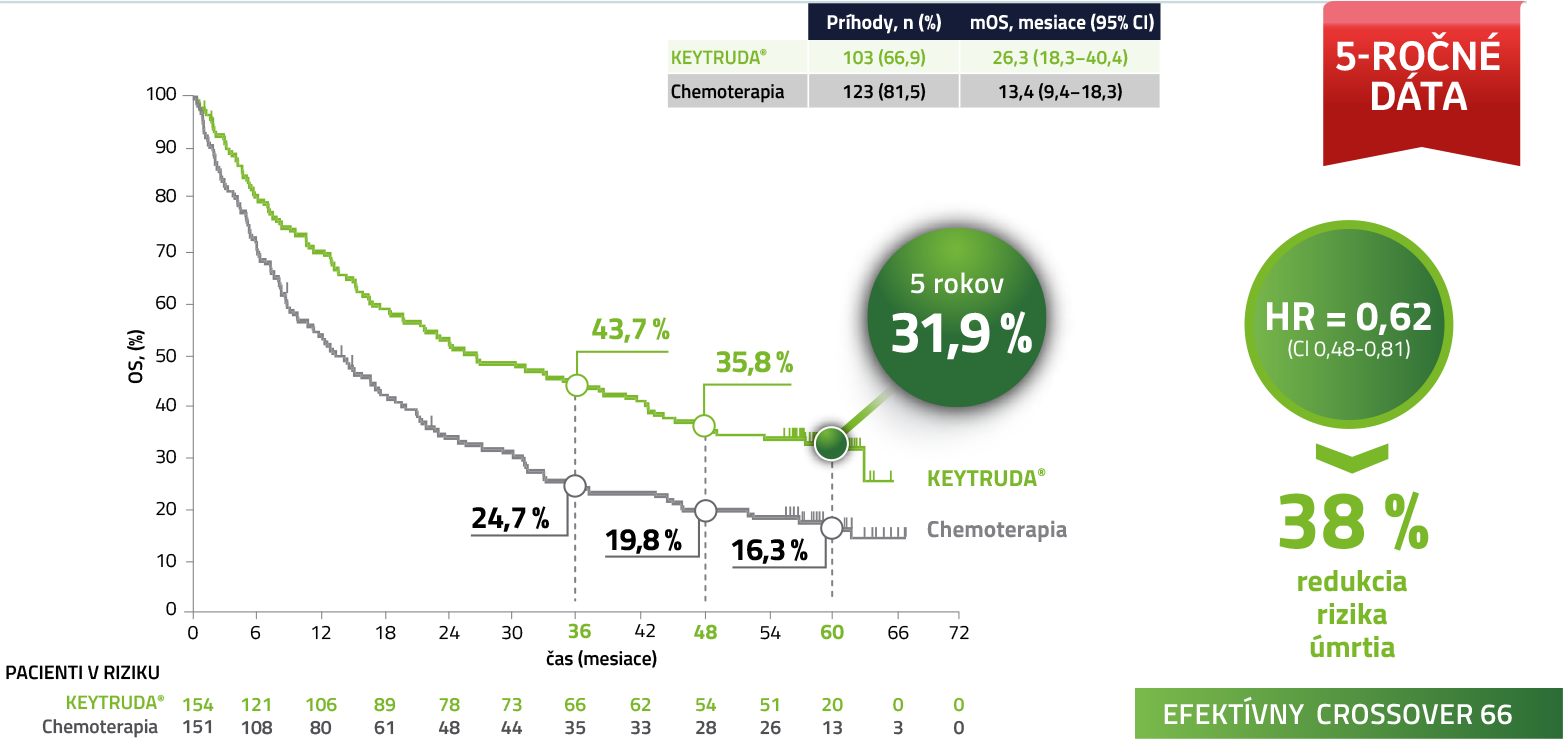
Medián sledovánia = 59,9 mesiacov (rozmedzie: 55,1–68,4 mesiacov). Uzávierka dát: 1. jún 2020.
a Efektívna miera prekríženia z chemoterapie na anti-PD-L1 terapiu, 66,0 % (99 pacientov celkovo prešlo na anti-PD-[L]1 terapiu: 83 pacientov prešlo počas štúdie na liek KEYTRUDA®, 16 pacientov dostávalo následnú anti-PD-L1 terapiu mimo prekríženia; pacienti mohli dostávať >1 následnú anti-PD-L1 terapiu).
Analýza celkového prežívania (OS) upravená podľa crossoveru
Miera efektívneho prekríženia z chemoterapie na anti-PD-1 terapiu: 65,1 % (82 pacientov pokračovalo v liečbe v rámci štúdie liekom KEYTRUDA® a 15 dostávalo anti-PD-1 terapiu mimo crossover)6
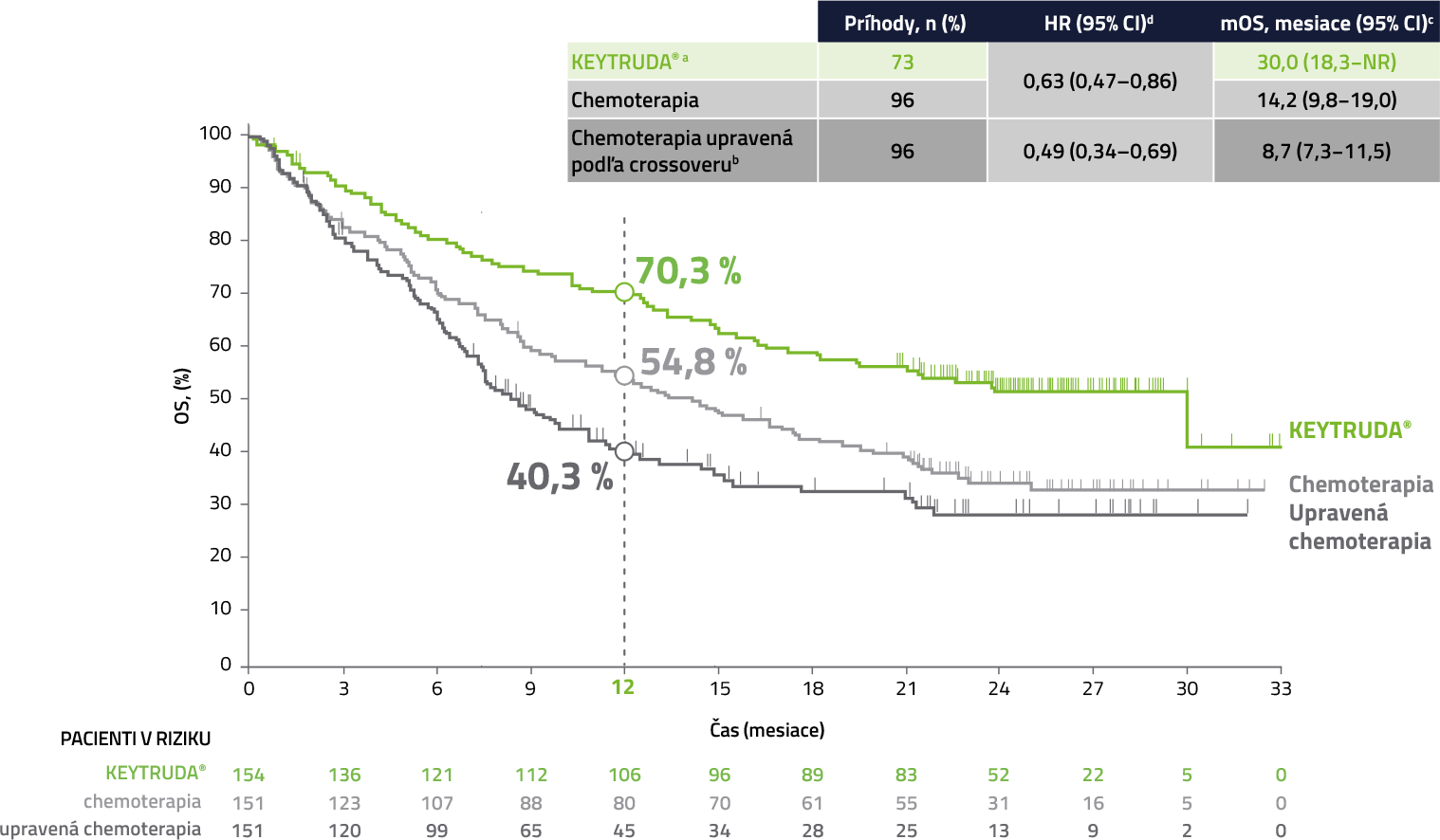
Medián sledovánia = 25,2 mesiacov (rozmedzie: 20,4–33,7 mesiacov). Uzávierka dát: 10. júl 2017.
a Doba prežitia zhrnutá pre pacientov vhodných k zaradeniu do metódy stupňa 2 a pacientov, ktorí skutočne prešli na liečbu liekom KEYTRUDA® 200 mg každé 3 týždňe.
b Z metódy obmedzenej na liek (Kaplan-Meierova) pre cenzúrované údaje.
c Na základe Coxova regresného modelu s liečbou ako kovariátu, stratifikovanej podľa histológie (SQ/NSQ), geografie (Východná Ázia/iná) a ECOG PS pri zaradení (0/1). 95% CI je založené na vzorkách získaných metódou bootstrap 1000/1000 z populáce ITT, stratifikovaných podľa liečebnej vetvy a vetvou liečených chemoterapiou.
d Nominálna hodnota p = 0,002.
PFS v populácii ITT 6,a,b
U pacientov liečených liekom KEYTRUDA® sa dosiahlo 50% zníženie rizika progresie ochorenia alebo úmrtia v porovnaní so skupinou liečenou chemoterapiou na báze platiny.
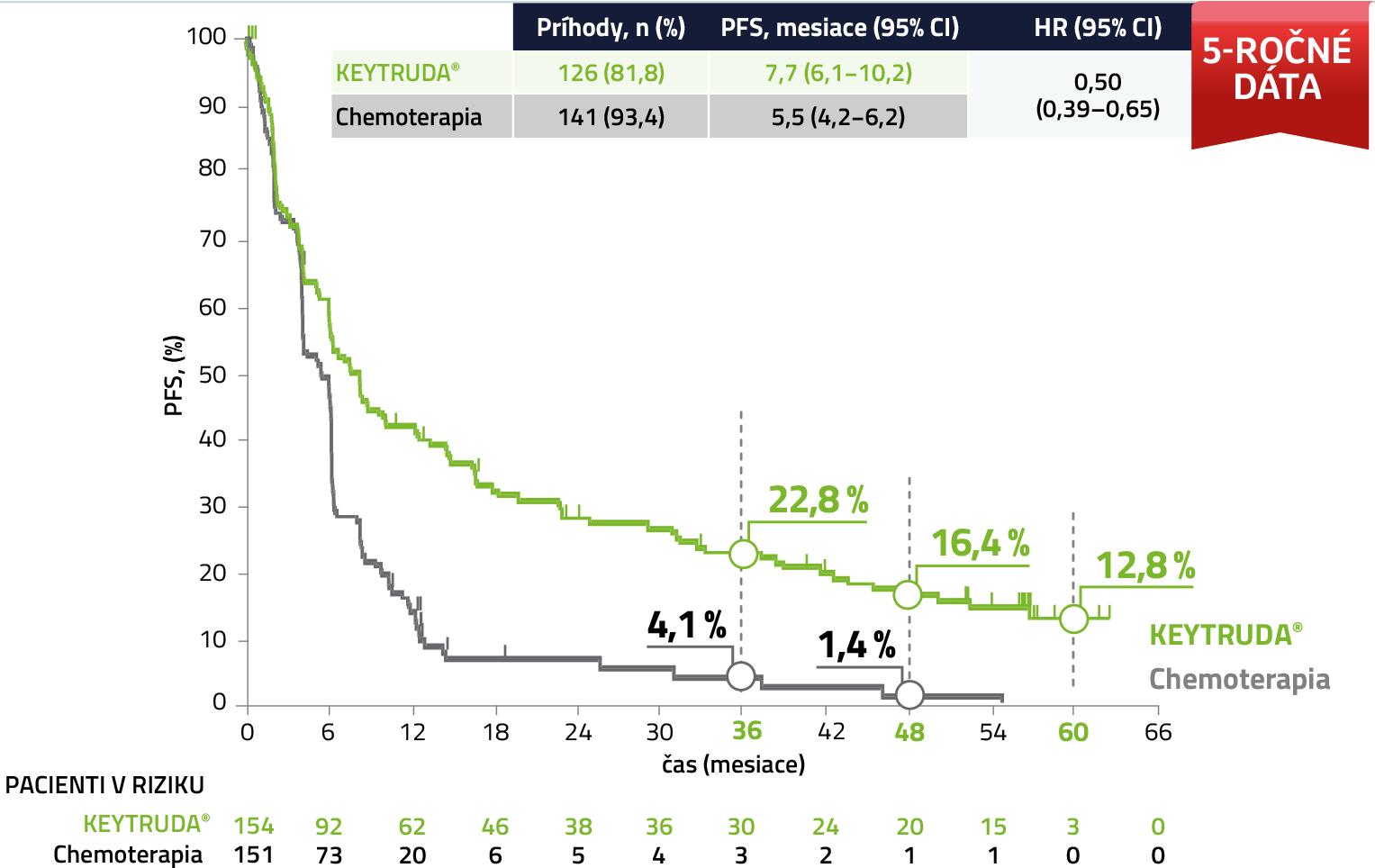
a Podľa RECIST v1.1 určené skúšajúcim.
b Sekundárne kritérium hodnotenia; primárnym kritériom hodnotenia bolo PFS hodnotené BICR.
Medián sledovania= 59,9 mesiacov (rozmedzie: 55,1–68,4 mesiacov).
Uzávierka dát: 1. jún 2020
Objektívna odpoveď v populácii (ITT)a
V 5-ročnej aktualizovanej exploračnej analýze bola pri liečbe liekom KEYTRUDA® pozorovaná vyššia objektívna odpoveď a vyššia mDOR vs. chemoterapia4,5
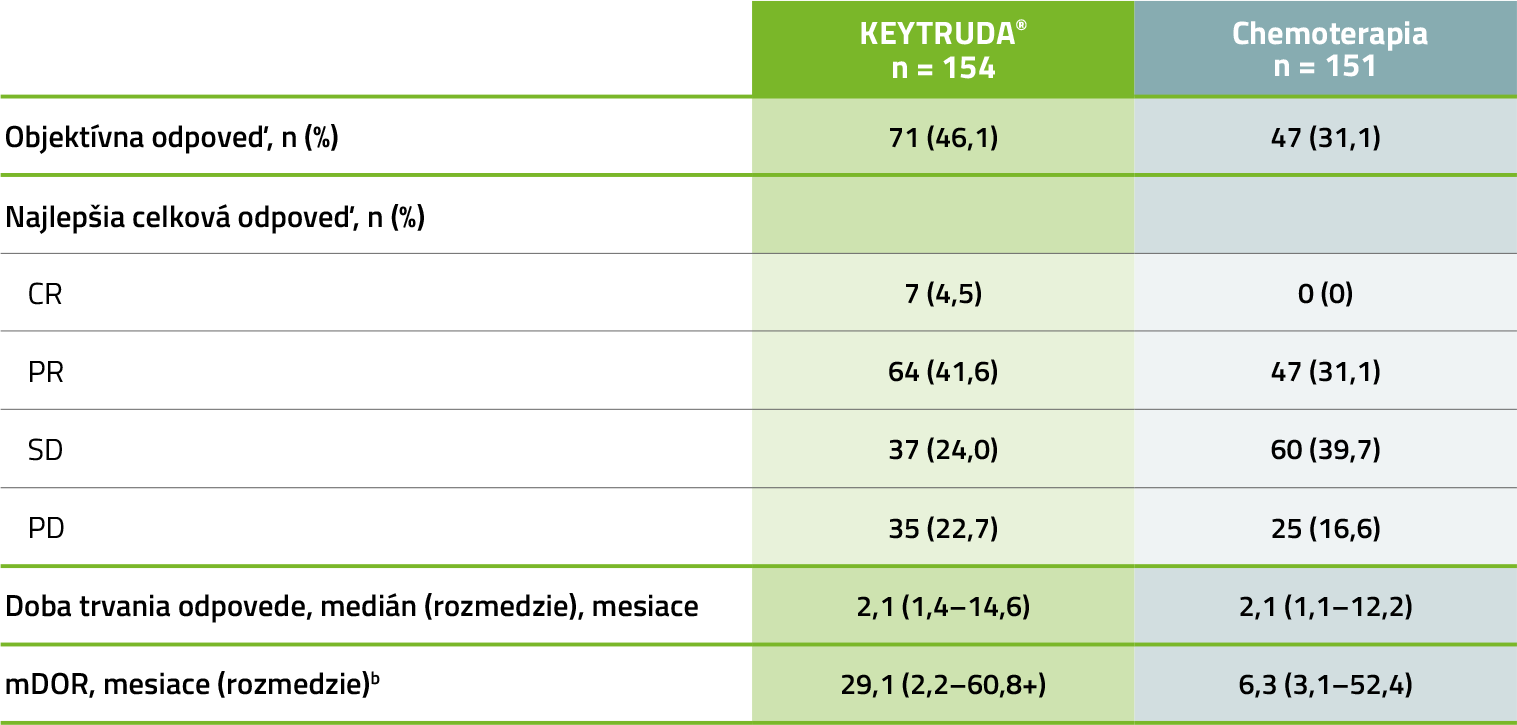
Medián sledovania = 59,9 mesiacov (rozmedzie: 55,1–68,4 mesiacov). Uzávierka dát: 1. jún 2020.
a Podľa RECIST v1.1 hodnotené skúšajúcim.
b „+” označuje, že trvanie odpovede je cenzurované.
Výsledky účinnosti pri pacientoch, ktorí dokončili 35 cyklov (2 roky) liečbu liekom KEYTRUDA® (n=39b)4,5
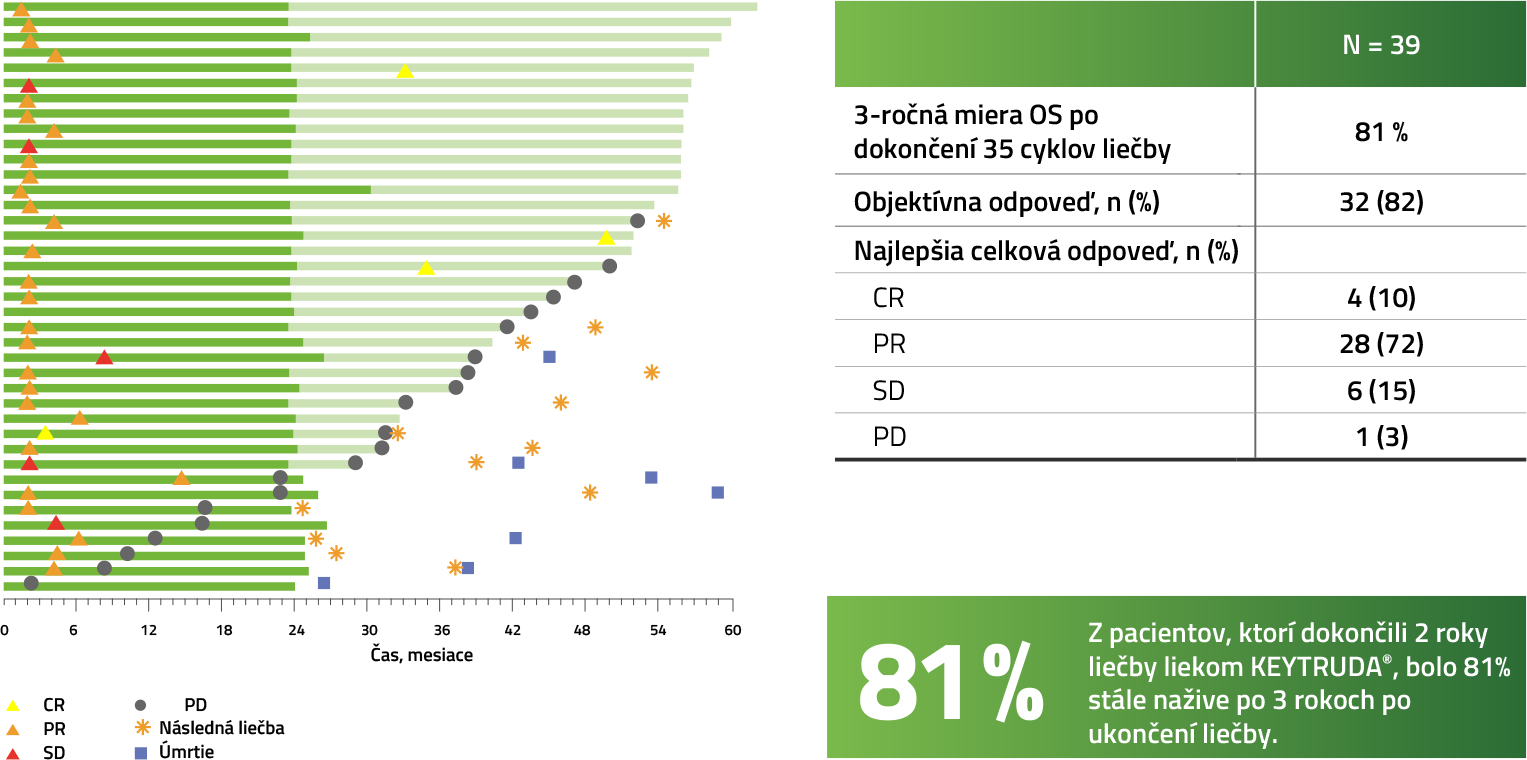
Medián sledovania celkovej populácie = 59,9 mesiacov (rozmedzie: 55,1–68,4 mesiacov). Uzávierka dát: 1. jún 2020.
a Tmavo zelené stĺpce predstavujú trvanie liečby prvým cyklom a svetlo zelené stĺpce predstavujú trvanie pozorovania po prvom cykle. Pozorovanie bolo definované ako doba do progresie alebo posledného vyšetrenia bez progresie hodnotené skúšajúcim. Odpoveď bola hodnotená skúšajúcim podľa RECIST v1.1.
b 7 pacientov zomrelo, všetci v dôsledku PD; 2 nedostávali žiadnu dodatočnú liečbu.
c U 1 pacienta sa vyvinula sekundárna malignita a bol liečený zodpovedajúcim spôsobom.
Prehľad nežiaducich reakcií
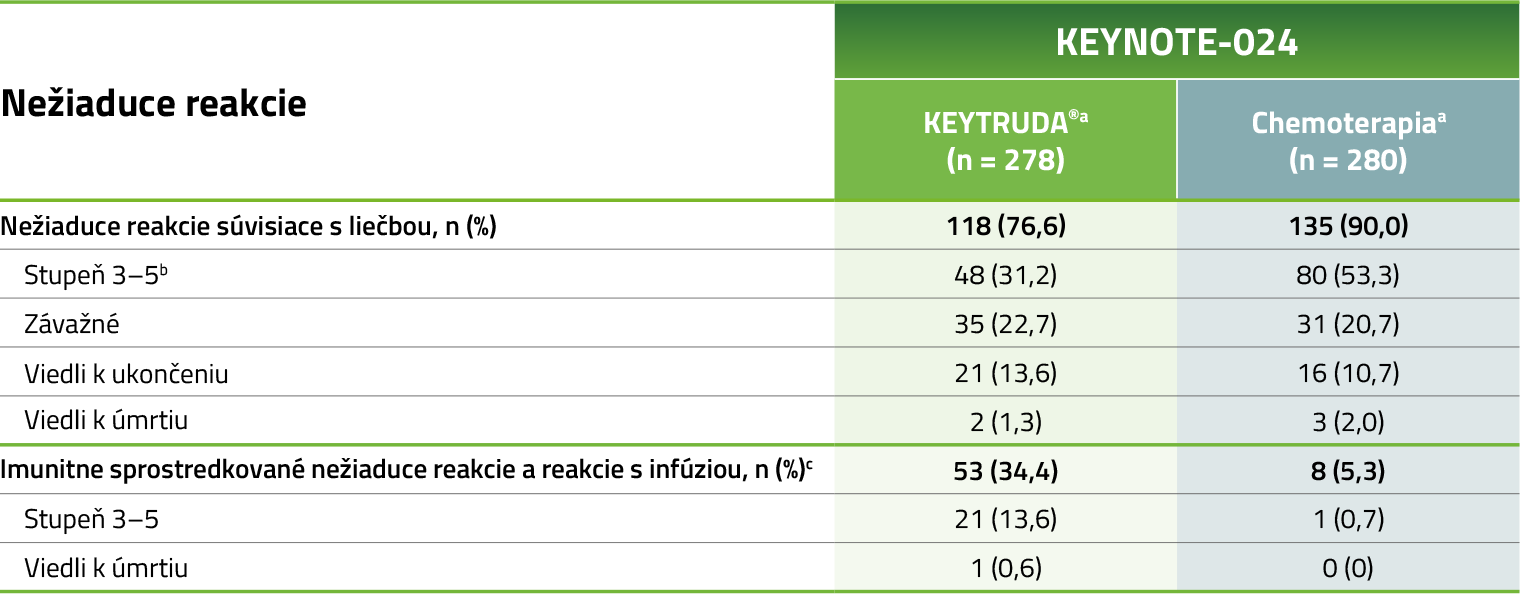
Pri 5-ročnom sledovaní neboli pozorované žiadne nové bezpečnostné signály oproti primárnej analýze.
Medián sledovania = 59,9 mesiacov (rozmedzie: 55,1–68,4 mesiacov). Uzávierka dát: 1. jún 2020.
a Počas liečby pôvodne priradenou terapiou.
b 7 ďalších pacientov v ramene liečených liekom KEYTRUDA® a žiadny ďalší pacienti v ramene liečení chemoterapiou nemali od počiatočnej publikácie štúdie KEYNOTE-024 nežiaduce reakcie súvisiace s liečbou stupňa 3–57
Od aktualizovanej analýzy po mediáne sledovania 25,5 mesiacov nedošlo k žiadnej zmene.6
c Bez ohľadu na priradenie liečby skúšajúcim.
PFS2 (prežívanie bez progresie)
U pacientov liečených liekom KEYTRUDA® v 1. línii bolo pozorované 49% zníženie rizika progresie v 2. línii vs. chemoterapia na báze platiny.5
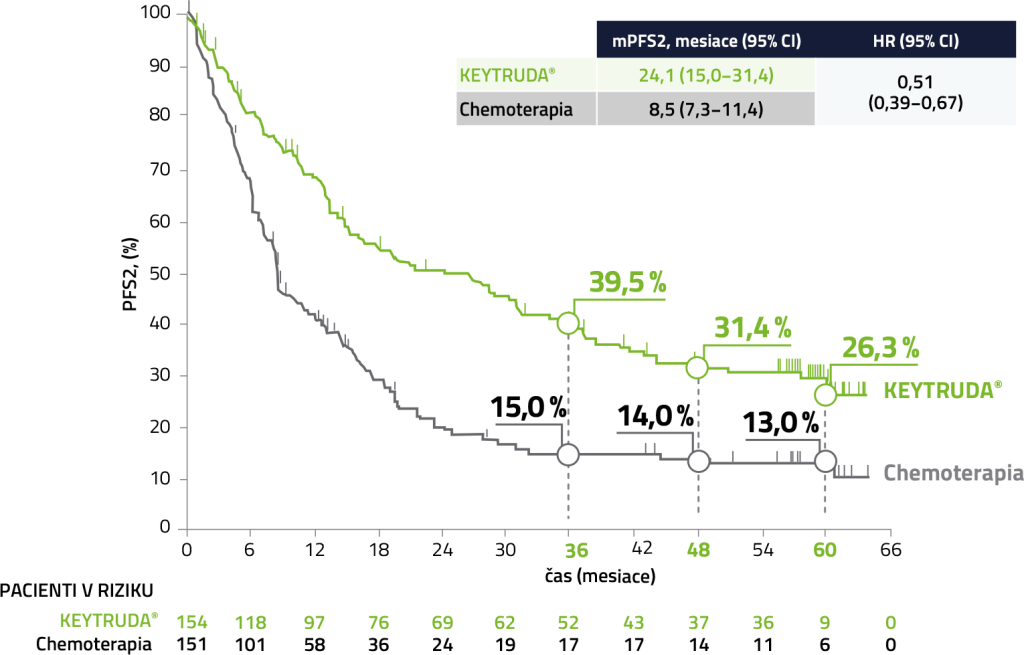
Medián sledovania = 59,9 mesiacov (rozmedzie: 55,1–68,4 mesiacov). Uzávierka dát: 1.jún 2020.
Klinické štúdie pre metastatický nemalobunkový karcinóm pľúc:
Skratky:
CR: complete response. DOR: duration of response. PD: progressive disease. PR: partial response. SD: stable disease.
Referencie:
1. Súhrn charakteristických vlastností lieku KEYTRUDA®
2. Zoznam kategorizovaných liekov Časť B: Indikačné obmedzenia
3. Reck M, Rodríguez-Abreu D, Robinson AG, et al. Five-year outcomes with pembrolizumab versus chemotherapy for metastatic non–small-cell lung cancer with PD-L1 tumor proportion score 50%. J Clin Oncol. 2021;JCO2100174. doi:10.1200/JCO.21.00174
4. Brahmer et al. Presented at ESMO 2020. Abstract LBA51
5. Reck M et al. J Clin Oncol. 2021;39(21):2339-2349.
6. Reck M et al. J Clin Oncol. 2019; 37(7):537-546.
7. Reck M, et al. N Engl J Med. 2016;375:1823-1833.
Výdaj lieku je viazaný na lekársky predpis. Pred predpísaním si prosím preštudujte Súhrn charakteristických vlastností lieku.