Dizajn klinickej štúdie KEYNOTE-8261,2
Randomizovaná, dvojito zaslepená, placebom kontrolovaná klinická štúdia fázy 3 hodnotiaca liečbu liekom KEYTRUDA® + chemoterapia ± bevacizumab u pacientok s perzistentným, rekurentným alebo metastatickým karcinómom krčka maternice v prvej línii liečby.1,2
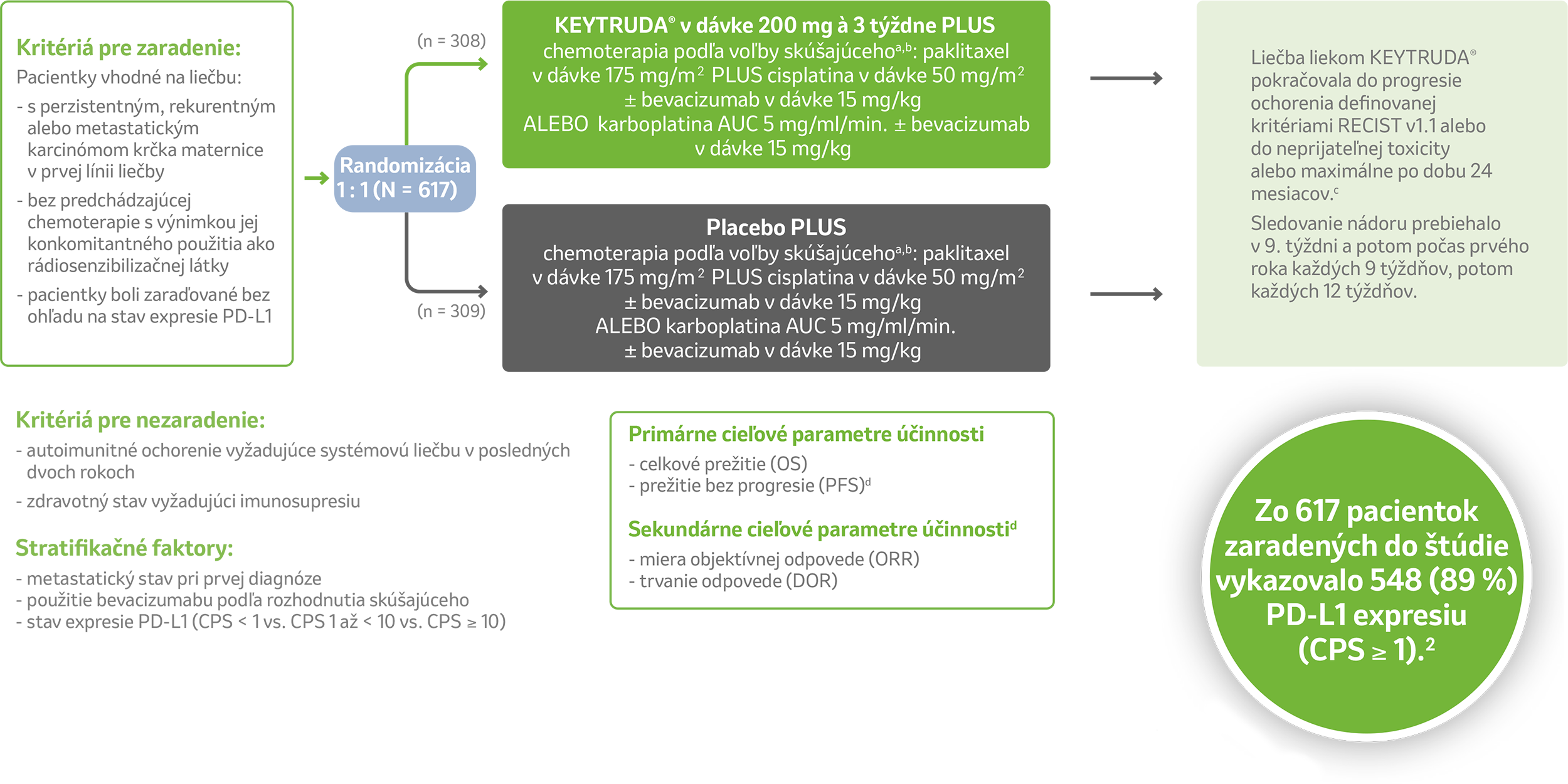
Upravené podľa Colombo et al. 2021.²
ᵃ Všetka študijná liečba bola podávaná ako intravenózna infúzia.
ᵇ Všetka študijná liečba bola podávaná 1. deň každého 3-týždňového liečebného cyklu. Cisplatina mohla byť podávaná 2. deň každého 3-týždňového liečebného cyklu.
⁴ Podávanie lieku KEYTRUDA® bolo povolené po progresii ochorenia definovanej kritériami RECIST v1.1, pokiaľ bola pacientka stabilná a skúšajúci považoval liečbu za klinicky prínosnú.
⁵ Hodnotenie skúšajúceho podľa kritérií RECIST v1.1.
Skratky:
AUC = plocha pod krivkou; CPS = kombinované pozitívne skóre; PD-L1 = ligand receptora programovanej bunkovej smrti 1; RECIST v1.1 = Kritériá hodnotenia odpovede na liečbu
Charakteristiky pacientov v ITT populácii2
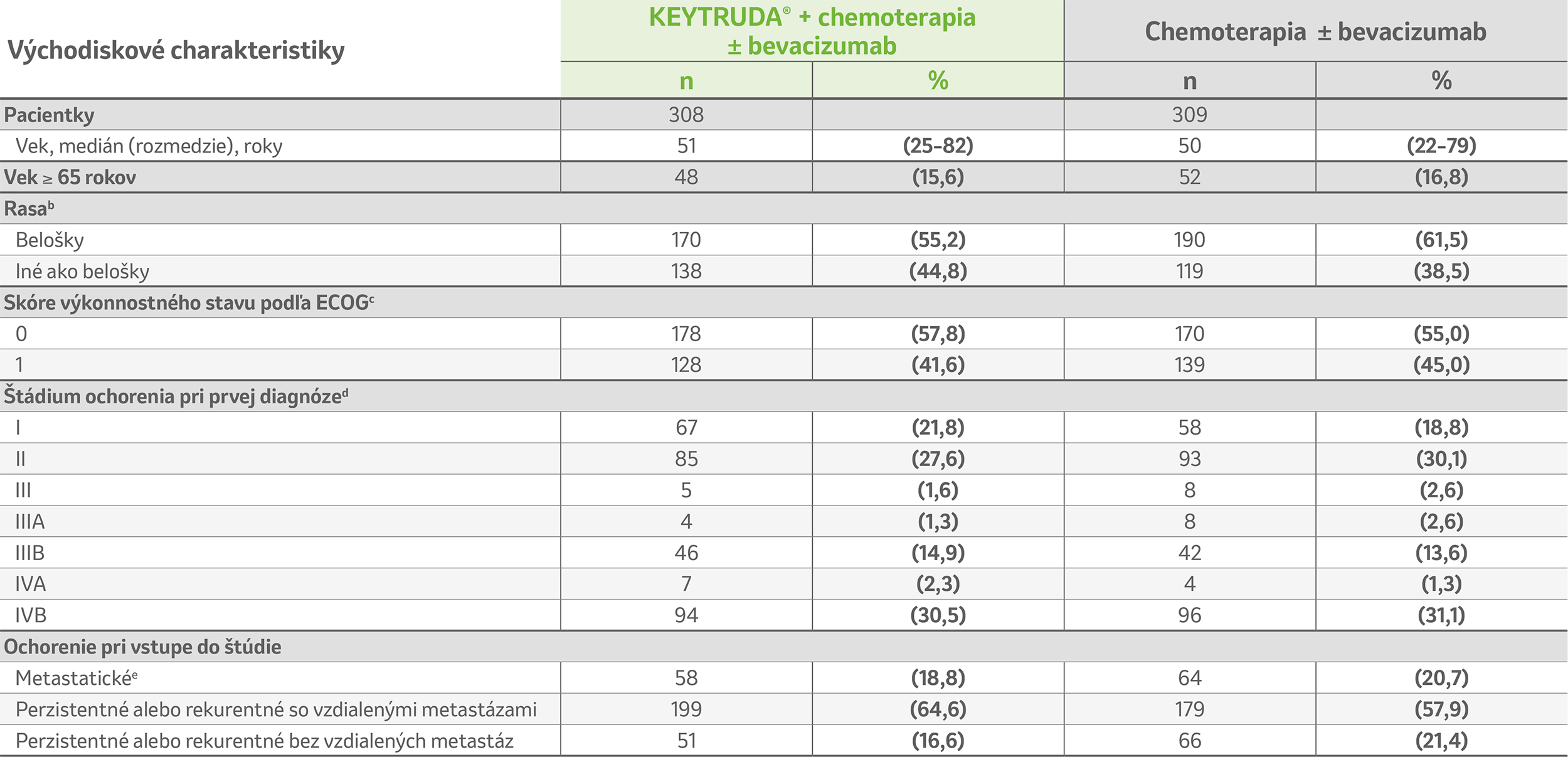
Upravené podľa Colombo et al. 2021.²
Poznámky:
ECOG: Východná kooperatívna onkologická skupina; ITT: so zámerom liečiť
a Populácia so zámerom liečiť (ITT) zahŕňala všetky pacientky, ktoré podstúpili randomizáciu. Súčet percent nemusí byť kvôli zaokrúhľovaniu rovný 100.
a Rasa bola uvádzaná pacientkou alebo skúšajúcim podľa miestnej praxe a pokiaľ to bolo povolené zákonom.
b Skóre výkonnostného stavu podľa Východiskovej kooperatívnej onkologickej skupiny (ECOG) má hodnoty od 0 do 5, kde 0 znamená žiadne príznaky a vyššie skóre znamená narastajúcu disabilitu. V ramene s liekom KEYTRUDA® mala jedna pacientka (0,3 %) skóre výkonnostného stavu ECOG 2 a jedna pacientka (0,3 %) mala skóre neznáme.
c Štádium ochorenia bolo určované pomocou kritérií Medzinárodnej federácie gynekológiu a pôrodníctvo (FIGO) 2009 – Národná komplexná sieť pr nádorové ochorenia (NCCN) 2007.
4 Do tejto kategórie sú zahrnuté aj pacientky s postihnutím paraaortálnych lymfatických uzlín. Pacientky s metastatickým ochorením boli diagnostikované v štádiu IVB a vstúpili do štúdie bez akejkoľvek predchádzajúcej liečby karcinómu krčka maternice.
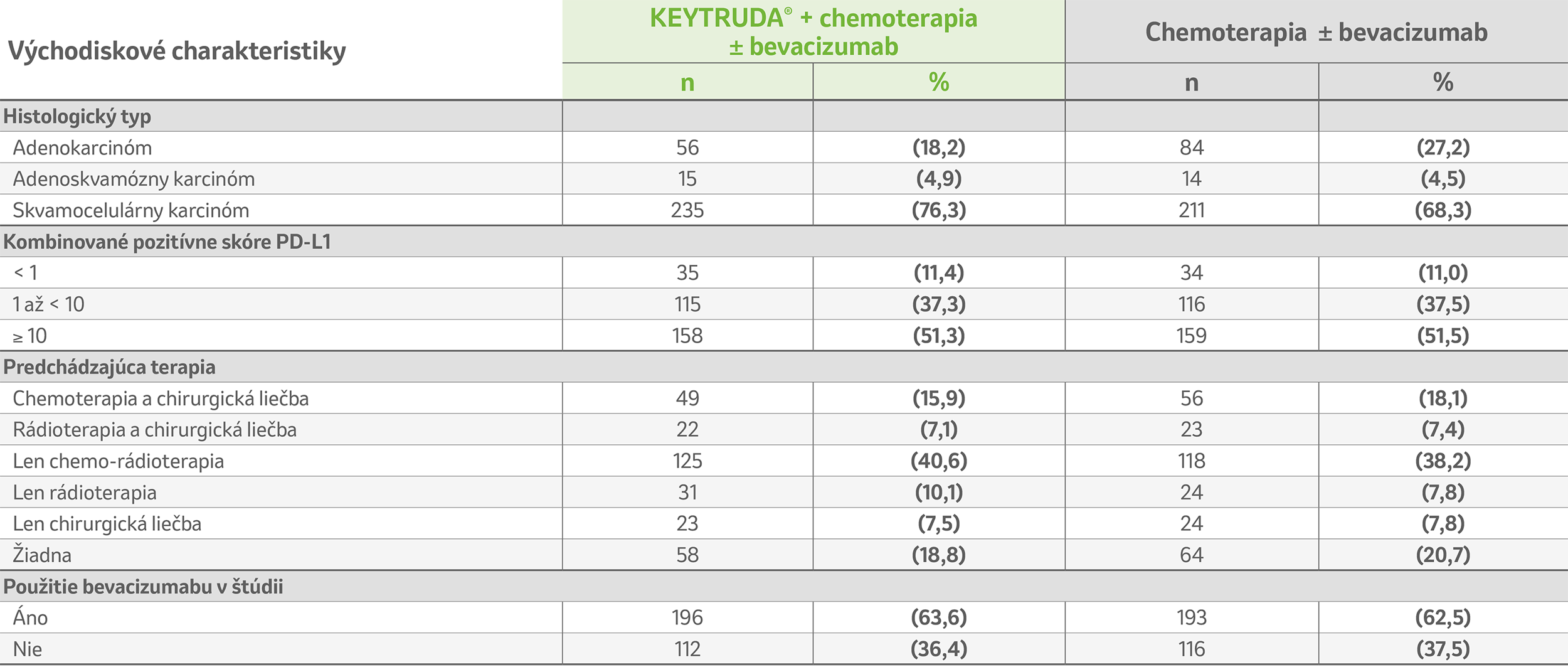
Upravené podľa Colombo et al. 2021.2
ᵃ Populácia so zámerom liečiť (ITT) zahrnula všetky pacientky, ktoré podstúpili randomizáciu. Súčet percent nemusí byť kvôli zaokrúhľovaniu rovný 100.
ᵇ V skupine liečenej liekom KEYTRUDA® bol histologický typ u jednej pacientky (0,3 %) zaznamenaný ako epidermoidný karcinóm a u jednej pacientky (0,3 %) ako nediferencovaný karcinóm.
ITT: so zámerom liečiť; PD-L1: ligand receptora programovanej bunkovej smrti 1.
Prežívanie bez progresie v populácii pacientok s expresiou PD-L1 (CPS ≥ 1)3
Predĺženie PFS v ramene s liekom KEYTRUDA® + chemoterapia ± bevacizumab v porovnaní s ramenom chemoterapia ± bevacizumab u pacientiek, ktorých nádory exprimujú PD-L1 (CPS ≥ 1)3
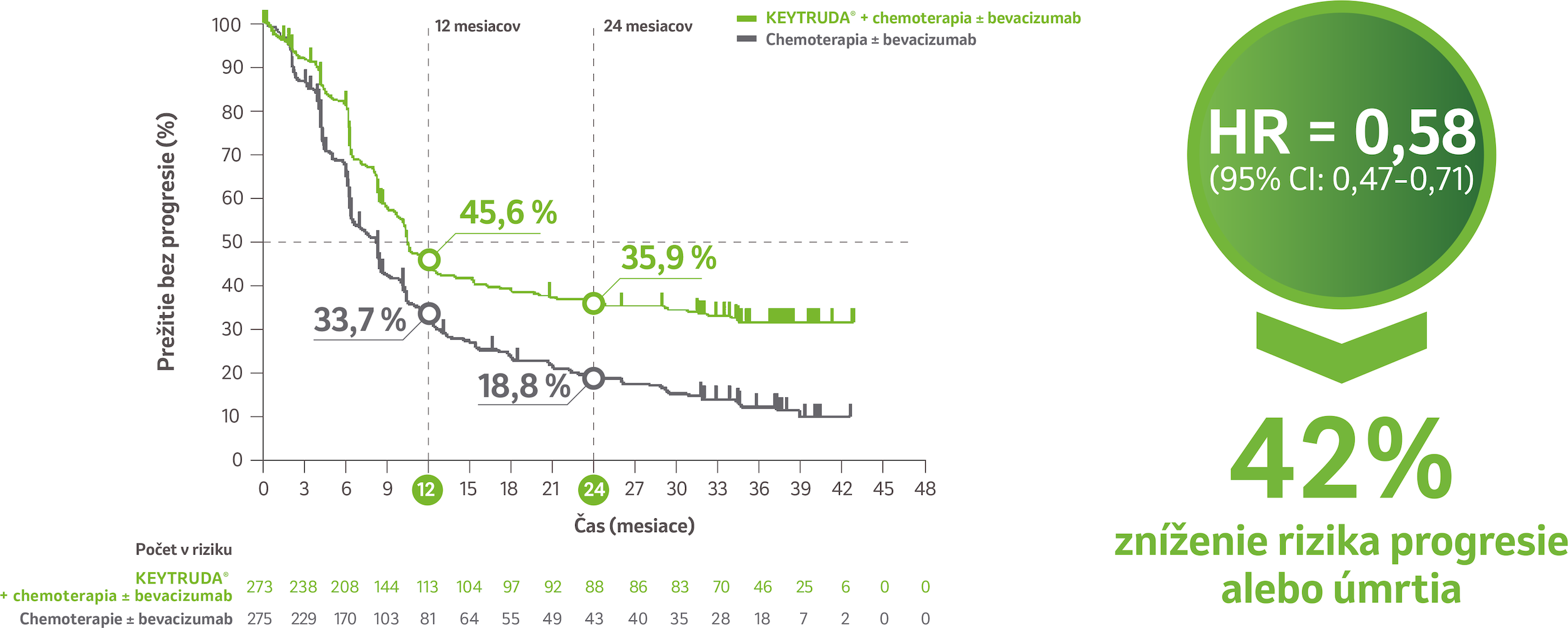
Počet pacientiek s udalosťou 171/273 (62,6 %) v ramene s liekom KEYTRUDA® vs. 220/275 (80 %) v ramene s placebom. Medián PFS v populácii s CPS ≥ 1 bol 10,5 mesiaca (95 % CI: 9,7–12,3) v ramene s liekom KEYTRUDA® + chemoterapia ± bevacizumab vs. 8,2 mesiaca (95 % CI: 6,3–8,5) v ramene chemoterapie ± bevacizumab pri mediáne sledovania 39,1 mesiaca.3
Na základe stratifikovaného Coxovho modelu proporcionálnych rizík.
CI: interval spoľahlivosti; CPS: kombinované pozitívne skóre; HR: pomer rizík; NR: nedosiahnuté; PD-L1: ligand receptora programovanej bunkovej smrti 1; PFS:
prežitie bez progresie.
Obmedzenie: Pre túto vopred špecifikovanú finálnu analýzu nebolo vykonané formálne štatistické testovanie, preto z nej nemožno vyvodzovať závery.
Celkové prežívanie v populácii pacientok s expresiou PD-L1 (CPS ≥ 1)4
Predĺženie OS v ramene s liekom KEYTRUDA® + chemoterapia ± bevacizumab v porovnaní s ramenom chemoterapie ± bevacizumab u pacientiek, ktorých nádory exprimujú PD-L1 (CPS ≥ 1)4
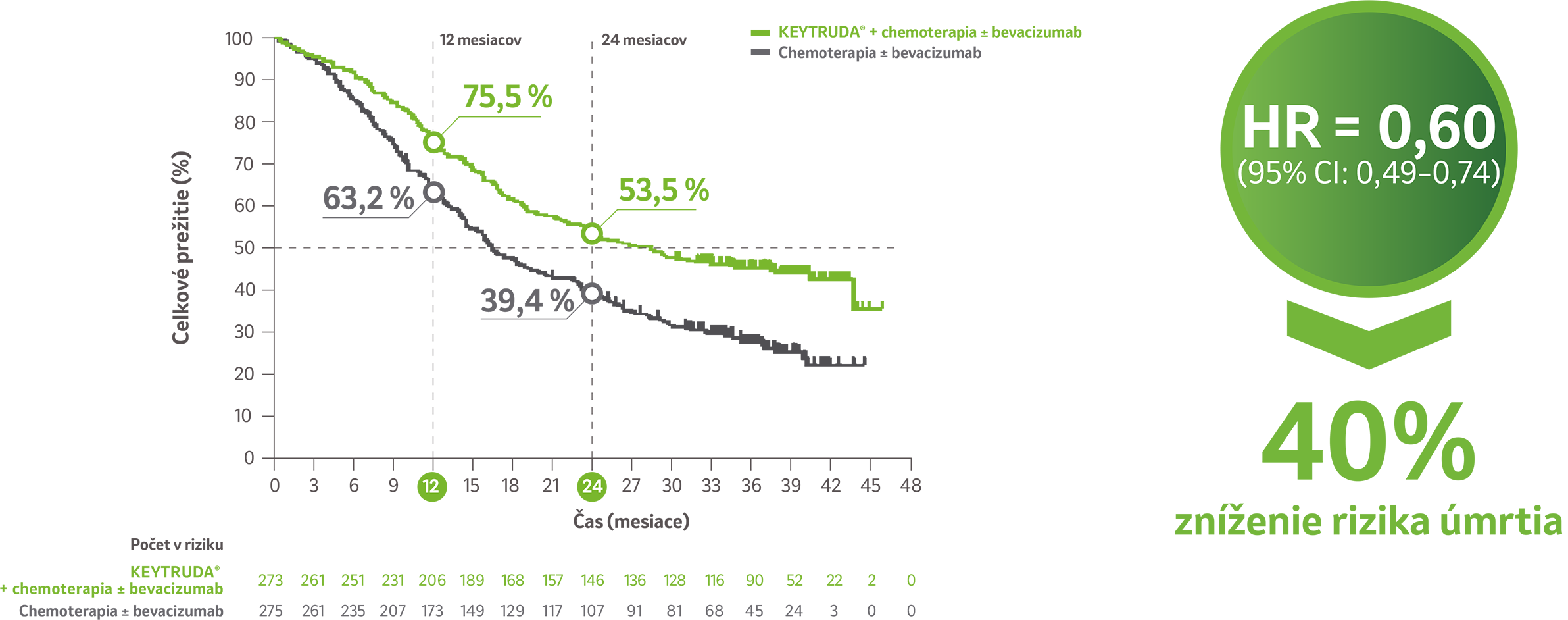
Počet pacientiek s príhodou 153/273 (56 %) v ramene s liekom KEYTRUDA® vs. 201/275 (73,1 %) v ramene s placebom. Medián OS bol 28,6 mesiaca (95 % CI: 22,1–38,0) v ramene s liekom KEYTRUDA® + chemoterapia ± bevacizumab. Medián OS v ramene chemoterapie ± bevacizumab bol 16,5 mesiaca (95 % CI: 14,5–20,0) pri mediáne sledovania 39,1 mesiaca.4
Na základe stratifikovaného Coxovho modelu proporcionálnych rizík.
CI: interval spoľahlivosti; CPS: kombinované pozitívne skóre; HR: pomer rizík; NR: nedosiahnuté; OS: celkové prežitie; PD-L1: ligand receptora programovanej
bunkovej smrti 1.
Obmedzenie: Pre túto vopred špecifikovanú finálnu analýzu nebolo vykonané formálne štatistické testovanie, preto z nej nemožno vyvodzovať závery.
Miera objektívnej odpovede (ORR) a trvanie odpovede (DOR)3
Vyššie ORR a dlhšie DOR v ramene s liekom KEYTRUDA® + chemoterapia ± bevacizumab v porovnaní s ramenom chemoterapiou ± bevacizumab u pacientiek, ktorých nádory exprimujú PD-L1 (CPS ≥ 1)3
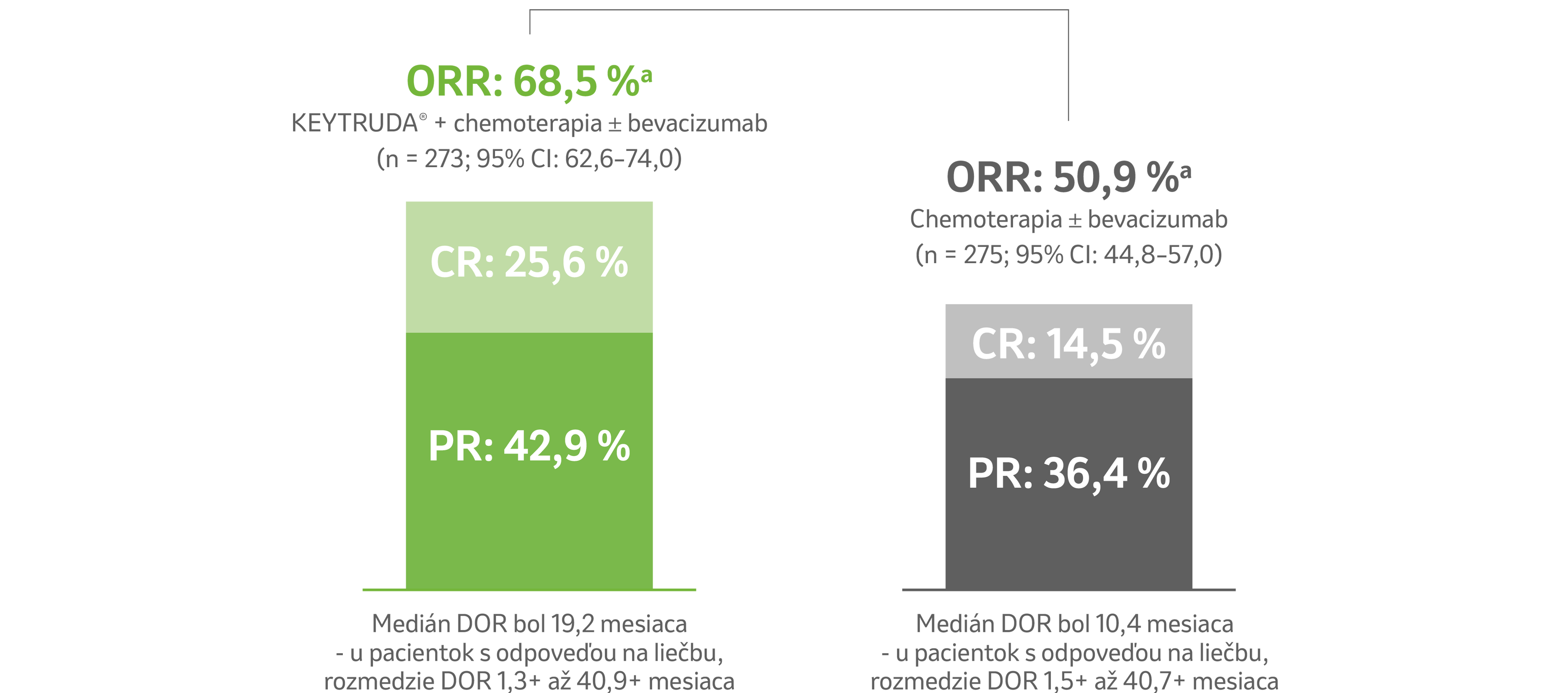
a Odpoveď: najlepšia objektívna odpoveď potvrdená ako kompletná odpoveď alebo čiastočná odpoveď. + Označuje trvajúcu odpoveď.
ORR: miera objektívnej odpovede; CR: kompletná odpoveď; PR: čiastočná odpoveď; DOR: trvanie odpovede; PD-L1: ligand receptora programovanej bunkovej
smrti 1; CI: interval spoľahlivosti; CPS: kombinované pozitívne skóre.
Obmedzenie: Pre túto vopred špecifikovanú finálnu analýzu nebolo vykonané formálne štatistické testovanie, preto z nej nemožno vyvodzovať závery.
Bezpečnostný profil podľa štúdie KEYNOTE-826
Nežiaduce účinky s výskytom ≥ 20 %3
Bezpečnostný profil u pacientok s perzistentným, rekurentným alebo metastatickým karcinómom krčka maternice v ramene s liekom KEYTRUDA® + chemoterapia ± bevacizumab bol konzistentný s už známymi profilmi jednotlivých liekov.3
Nežiaduce účinky v oboch ramenách s výskytom ≥ 20 % pri mediáne sledovania 39,1 mesiaca³
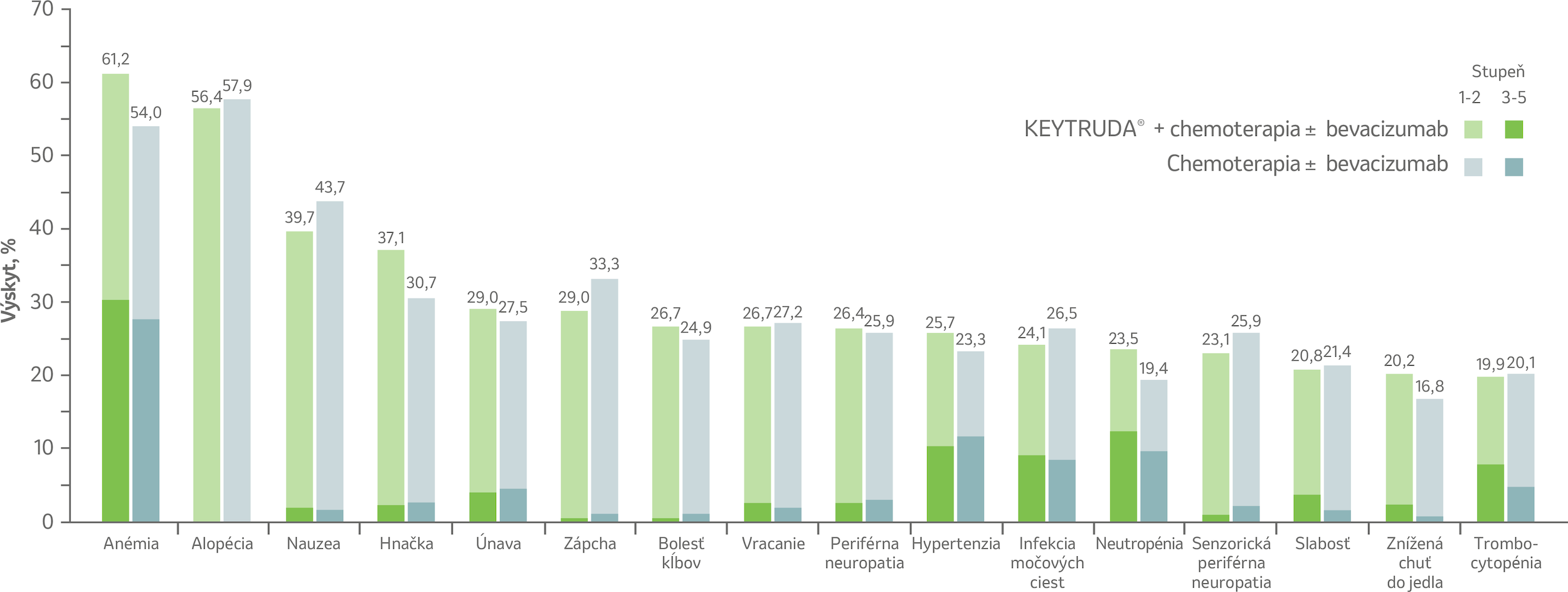
Dátum uzávierky: 3. október 2022
Nežiaduce účinky stupňa 3–5 sa vyskytli u 82,4 % z 307 liečených pacientiek v ramene s liekom KEYTRUDA® a u 75,4 % z 309 liečených pacientiek v ramene s placebom.3
Nežiaduce účinky viedli k ukončeniu celkovej študijnej liečby u 5,5 % pacientiek v ramene s liekom KEYTRUDA® a u 4,9 % pacientiek v ramene s placebom.3
Imunitne sprostredkované nežiaduce účinky s výskytom ≥ 2 %3
Imunitne sprostredkované nežiaduce účinky, incidencia ≥ 2 % v ktoromkoľvek ramene (liečená populácia)5
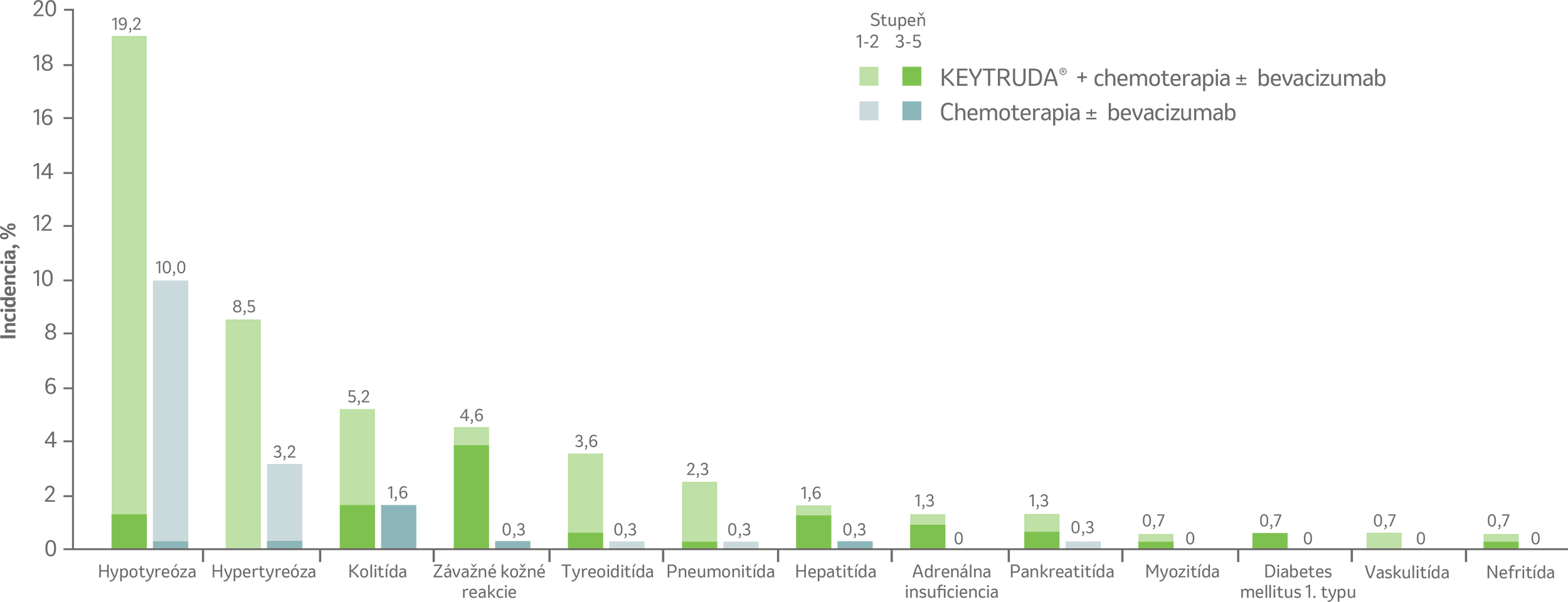
Účinky boli považované za imunitne sprostredkované, bez ohľadu na priradenie k liečbe v skúšajúcim. Uvedené špecifické termíny zahŕňali aj príbuzné termíny.
Liečená populácia zahŕňala všetky pacientky, ktoré podstúpili randomizáciu a dostali aspoň jednu dávku lieku KEYTRUDA® alebo placeba.5
Nežiaduce účinky a expozícia liečbe3
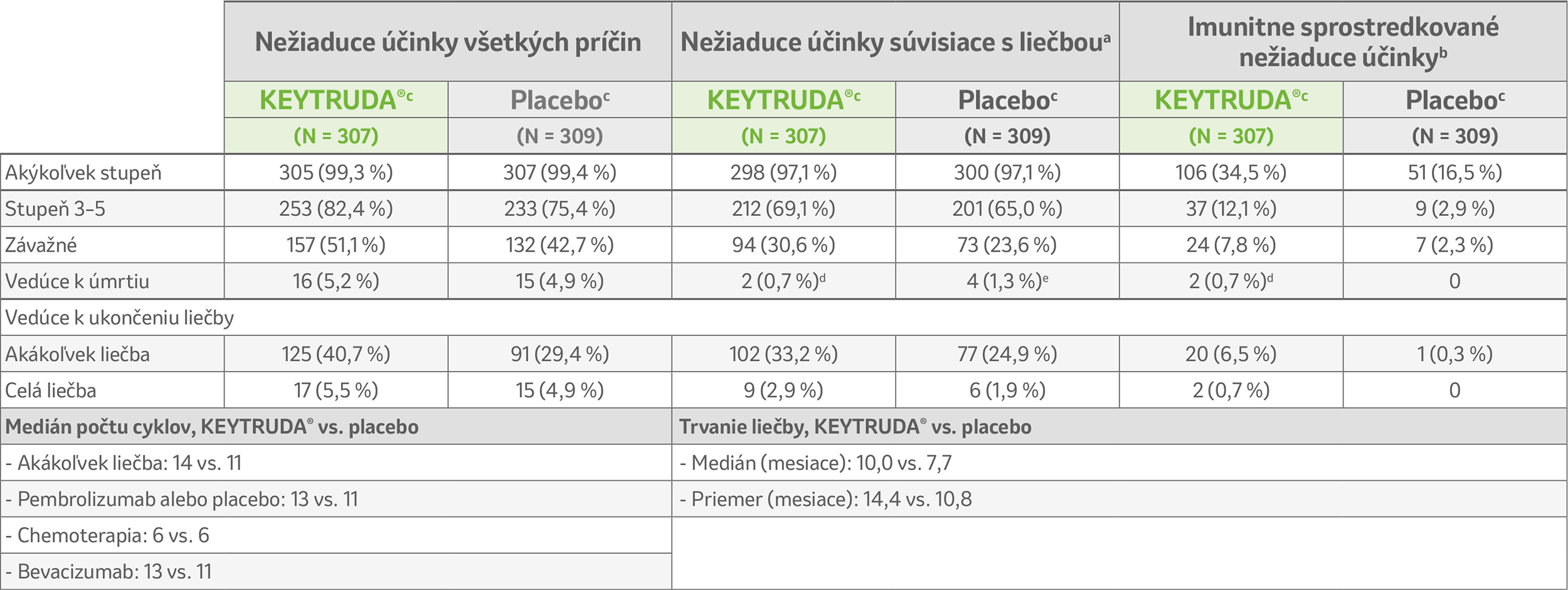
ITT: so zámerom liečiť; PD-L1: ligand receptora programovanej bunkovej smrti 1.
a Podľa zhodnotenia skúšajúceho.
b Účinky boli považované za imunitne sprostredkované, bez ohľadu na priradenie k liečbe v skúšajúcim.
c Liečebný režim v oboch skupinách zahŕňal chemoterapiu ± bevacizumab.
d Autoimunitná encefalitída (tiež imunitne sprostredkovaná) a perforácia čreva.
e Embólia, fistula ženského pohlavného ústrojenstva, perforácia hrubého čreva a pľúcnej sepsy.
Dátum uzávierky: 3. októbra 2022.
Referencie:
1.SPC lieku KEYTRUDA®.
2. Colombo N, et al. Pembrolizumab for persistent, recurrent, or metastatic cervical cancer. N Engl J Med. 2021;385:1856-67.
3. Monk BJ, Colombo N, Tewari KS, et al. Supplementary appendix to: First-line pembrolizumab + chemotherapy versus placebo + chemotherapy
for persistent, recurrent, or metastatic cervical cancer: final survival results of KEYNOTE-826. J Clin Oncol. 2023;JCO2300914. doi:10.1200/
JCO.23.00914.
4. Monk et al., First-Line Pembrolizumab + Chemotherapy Versus Placebo + Chemotherapy for Persistent, Recurrent, or Metastatic Cervical Cancer:
Final Overall Survival Results of KEYNOTE-826. J Clin Oncol. 2023;00:1-7.
Skratky
CC = karcinóm krčka maternice; CPS = kombinované pozitívne skóre; CI = interval spoľahlivosti; HR = pomer rizík; nab-paklitaxel = paklitaxel viazaný na proteín; PD-L1 = ligand receptora programovanej bunkovej smrti 1.
Výdaj lieku je viazaný na lekársky predpis. Pred predpísaním si prosím preštudujte Súhrn charakteristických vlastností lieku.
