Kliknutím preskúmate výsledky celkového prežívania v štúdii KEYNOTE-522 (sekundárny ukazovateľ účinnosti)
Nenaplnená medicínska potreba v liečbe eTNBC
Vo všeobecnosti majú niektorí pacienti s TNBC zlé výsledky v dôsledku rekurencie napriek ich počiatočnej liečbe.2-4
Tieto vysoké miery rekurencie zdôrazňujú potrebu efektívnejšej liečby.3
KEYTRUDA® (pembrolizumab) je hradená v kombinácii s chemoterapiou ako neoadjuvantná liečba s následným pokračovaním vo forme monoterapie ako adjuvantná liečba po chirurgickom zákroku u dospelých s lokálne pokročilým trojnásobne negatívnym karcinómom prsníka alebo trojnásobne negatívnym karcinómom prsníka v skorom štádiu s vysokým rizikom rekurencie.5
Hradená liečba podlieha prechádzajúcemu súhlasu zdravotnej poisťovne.

Prvá a jediná anti-PD-1 liečba indikovaná pre vysokorizikové skoré štádium TNBC ako neoadjuvantná kombinovaná liečba, po ktorej nasleduje adjuvantná monoterapia.5-10

Zistite viac o štúdii
KEYNOTE-522: Prehľady účinnosti
Štúdia KEYNOTE-522 hodnotí účinnosť a bezpečnosť neoadjuvantnej liečby KEYTRUDA® + chemoterapia, po ktorej nasleduje adjuvantná liečba KEYTRUDA® u pacientov s eTNBC.5
aChemoterapia: karboplatina a paklitaxel, po ktorých nasleduje doxorubicín alebo epirubicín s cyklofosfamidom.
eTNBC: skoré štádium trojnásobne negatívneho karcinómu prsníka; PD-L1: ligand receptora programovanej bunkovej smrti 1; TNBC: trojnásobne negatívny karcinóm prsníka.
KEYNOTE-522 je randomizované, multicentrické, dvojito zaslepené, placebom kontrolované klinické skúšanie vo fáze III, do ktorého bolo zaregistrovaných 1 174 pacientov s vysokorizikovým TNBC, lokálne pokročilým TNBC alebo TNBC v skorom štádiu.

Kľúčové kritériá pre zaradenie do štúdie
- Novo diagnostikovaný, nepredliečený, lokálne pokročilý TNBC alebo TNBC v skorom štádiu s vysokým rizikom recidívy.
- Veľkosť nádoru > 1 cm, ale zároveň ≤ 2 cm v priemere s postihnutím uzlín alebo veľkosť nádoru > 2 cm v priemere bez ohľadu na postihnutie uzlín.
- Zaradenie bez ohľadu na expresiu PD-L1 v nádore.

Kľúčové kritériá pre vyradenie zo štúdie
- Aktívne autoimunitné ochorenie, ktoré v predošlých dvoch rokoch pred zaradením do štúdie vyžadovalo systémovú terapiu.
- Zdravotný stav, ktorý si vyžaduje imunosupresiu.
Ďalšie kritériá vhodnosti na štúdiu nájdete v práci Schmid Schmid P et al., 2020.11
Liečebné skupiny štúdie5,11
- Randomizácia v pomere 2:1 do nasledujúcich liečebných skupín.b,c
- Všetky lieky v štúdii sa podávali intravenóznou infúziou.
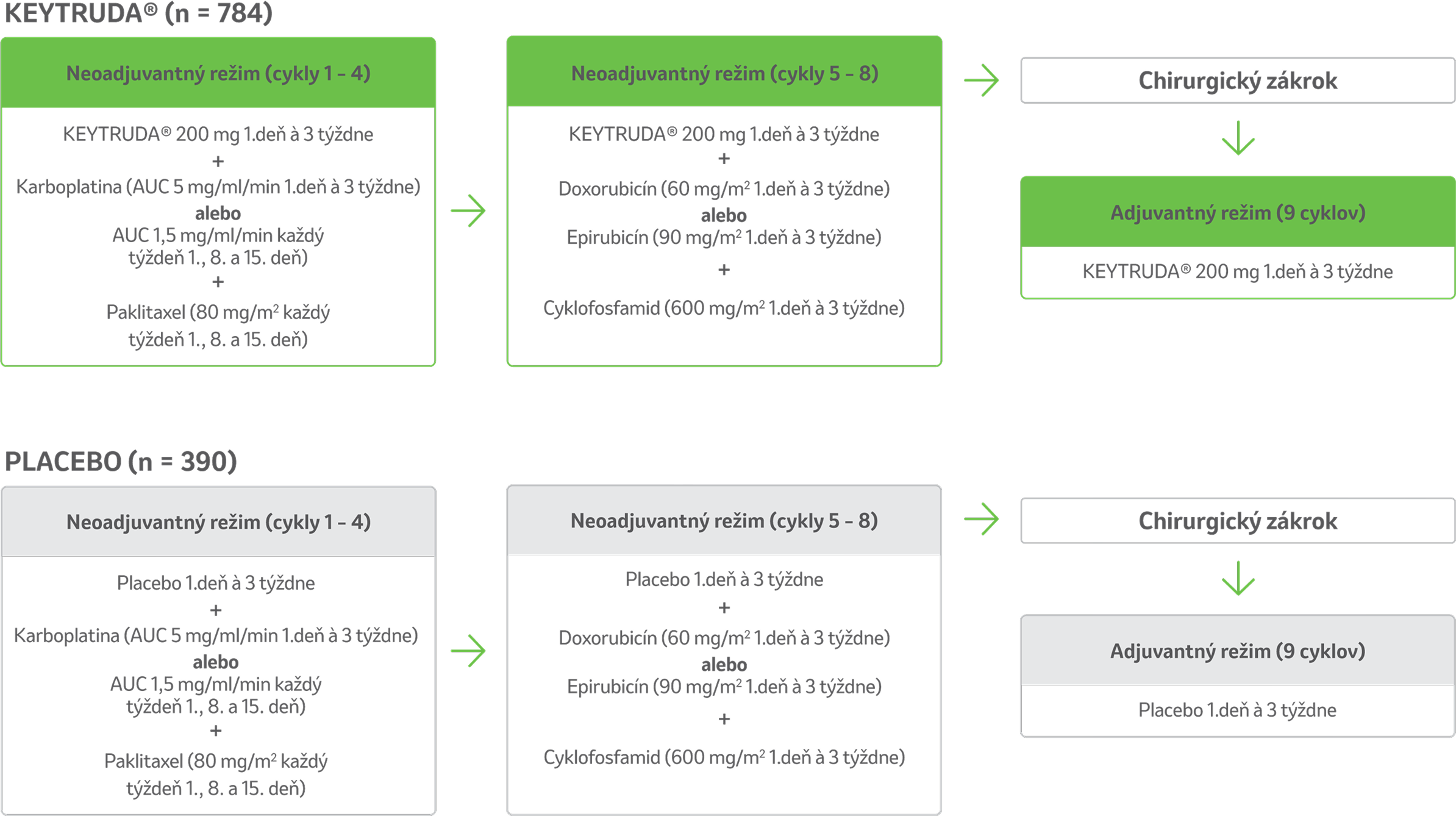
- Liečba liekom KEYTRUDA® alebo placebom pokračovala až do ukončenia liečby (17 cyklov), progresie ochorenia, ktorá by vylučovala definitívny chirurgický zákrok, rekurencie ochorenia v adjuvantnej fáze alebo neprijateľnej toxicity.
Primárne ukazovatele účinnosti
- pCR: Neprítomnosť invazívnej formy karcinómu prsníka a lymfatických uzlín (ypT0/Tis ypN0) a bola hodnotená zaslepeným miestnym patológom v čase definitívneho chirurgického zákroku.5
- EFS: Čas od randomizácie po prvý výskyt ktorejkoľvek z nasledujúcich udalostí: progresia ochorenia, ktorá vylučuje definitívny chirurgický zákrok, lokálna alebo vzdialená rekurencia, druhá primárna malignita alebo úmrtie z akejkoľvek príčiny v populácii s úmyslom liečiť.5
Sekundárne ukazovatele účinnosti
- OS definované ako čas od randomizácie do úmrtia z akejkoľvek príčiny (kľúčový sekundárny ukazovateľ účinnosti).1
- pCR definovaná ako ypT0 ypN0 a ypT0/Tis u všetkých pacientov.11
- pCR podľa všetkých definícií u pacientov s PD-L1 pozitívnymi nádormi.11
- EFS u pacientov s PD-L1 pozitívnymi nádormi.11
Bezpečnostné opatrenia
- Bezpečnosť v rámci neoadjuvantnej a adjuvantnej fázy bola hodnotená u všetkých pacientov, ktorí dostali minimálne jeden skúšaný liek, podstúpili chirurgický zákrok, alebo oboje.11
bKEYNOTE-522 je randomizované, multicentrické, dvojito zaslepené, placebom kontrolované klinické skúšanie vo fáze III, do ktorého bolo zaradených 1 174 pacientov s novo diagnostikovaným, predtým neliečeným vysokorizikovým TNBC, lokálne pokročilým TNBC v skorom štádiu alebo TNBC. Pacienti boli randomizované v pomere 2:1, aby dostávali buď liek KEYTRUDA® v kombinácii s chemoterapioua ako neoadjuvantnú liečbu, po ktorej nasledovala monoterapia liekom KEYTRUDA® ako adjuvantná liečba po chirurgickom zákroku, alebo placebo a chemoterapiua ako neoadjuvantnú liečbu, po ktorej nasledovalo placebo po chirurgickom zákroku. Liečba liekom KEYTRUDA® alebo placebom pokračovala až do ukončenia liečby (17 cyklov), progresie ochorenia, ktorá by vylučovala definitívny chirurgický zákrok, recidívy ochorenia v adjuvantnej fáze alebo neprijateľnej toxicity. Primárnymi ukazovateľmi účinnosti boli patologická kompletná odpoveď a prežívanie bez udalosti. Celkové prežívanie bolo jedným z niekoľkých sekundárnych ukazovateľov účinnosti.
cRandomizácia bola stratifikovaná podľa stavu uzlín (pozitívne v porovnaní s negatívnym), veľkosti nádoru (T1/T2 v porovnaní s T3/T4) a výberu karboplatiny (dávkovanie každé 3 týždne v porovnaní s týždenným).
AUC: oblasť pod krivkou; EFS: prežívanie bez udalosti; eTNBC: skoré štádium trojnásobne negatívneho karcinómu prsníka; N: postihnutie uzlín; OS: celkové prežívanie; pCR: kompletná patologická odpoveďe; PD-L1: ligand receptora programovanej bunkovej smrti 1.

Nádor a uzliny
7% malo primárny nádor 1 (T1), 68% T2, 19% T3, a 7% T4.
49% malo postihnutie uzlín 0 (N0), 40% N1, 11% N2, a 0.2% N3.
83% bolo PD-L1 pozitívnych, 17% bolo PD-L1 negatívnych.11
CI: interval spoľahlivosti; ECOG PS: výkonnostný stav podľa Východnej spolupracujúcej onkologickej skupiny (Eastern Cooperative Oncology Group); N: postihnutie uzlín; PD-L1: ligand receptora programovanej bunkovej smrti 1.
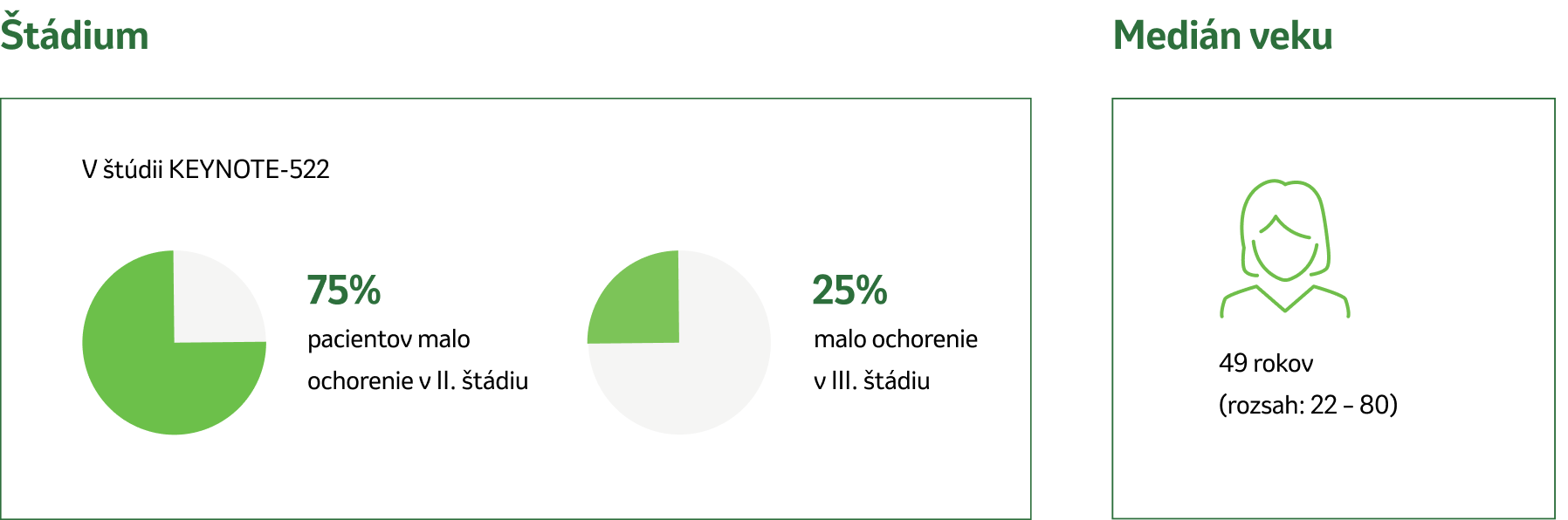
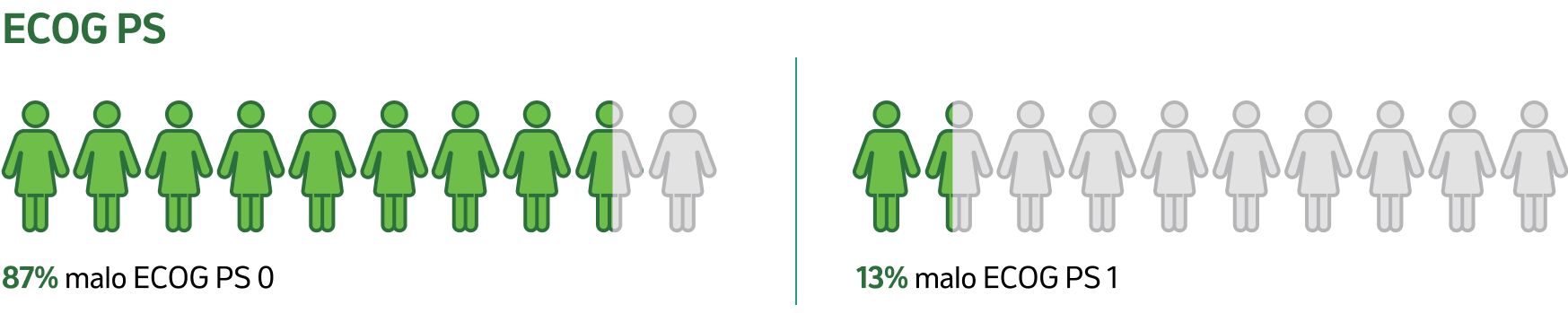
Štúdia KEYNOTE-522 uvádza kľúčové charakteristiky pacientov, ktoré určujú vhodnosť pre úplnú neoadjuvantnú a adjuvantnú liečbu:5
Veľkosť nádoru > 1 cm, ale ≤ 2 cm v priemere s postihnutím lymfatických uzlín

Veľkosť nádoru > 2 cm v priemere bez ohľadu na postihnutie lymfatických uzlín

Bez ohľadu na expresiu
PD-L1 v nádore

Ďalšie kritériá vhodnosti na štúdiu nájdete v práci Schmid P et al., 2020.11
N-: negatívne lymfatické uzliny; N+: pozitívne lymfaticé uzliny; PD-L1: ligand receptora programovanej bunkovej smrti 1.
Miera kompletnej patologickej odpovede (pCR)5
Pri vopred špecifikovanej záverečnej analýze (n = 1002) o 9,2% viac pacientov dosiahlo pCRe s režimom KEYTRUDA® + chemoterapiaa vs. placebo + chemoterapia (95 % CI, 2,8 – 15.6); p = 0,00221f ).
Medián sledovania 73,1 mesiacov (rozsah 2,7 – 83,9 mesiacov).
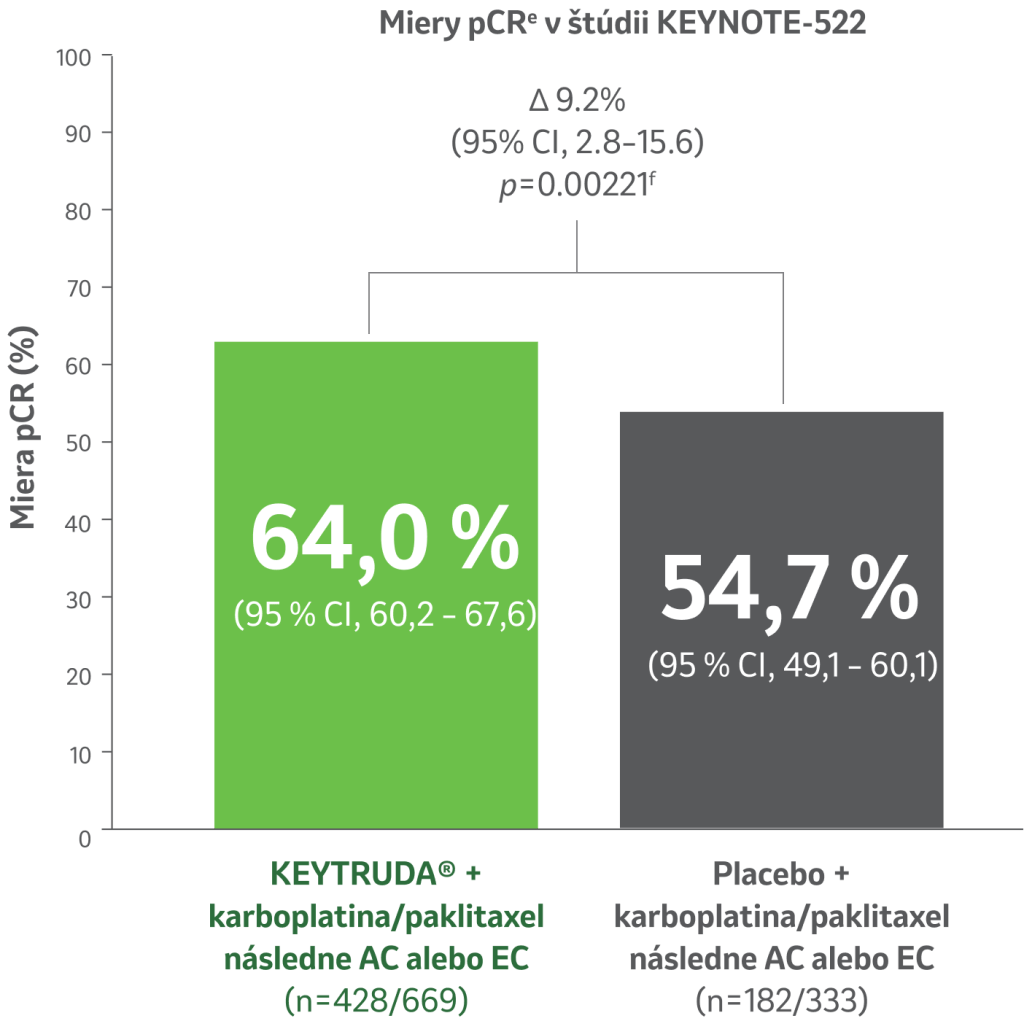

Režim KEYTRUDA® preukázal menej invazívneho reziduálneho tkaniva v prsníku alebo uzlinách v čase definitívnej operácie a lepšie výsledky u pacientov v porovnaní s placebom.5
Údaje o prežívaní bez udalosti:5
Štúdia preukázala štatisticky významné zlepšenie EFS pri vopred špecifikovanej predbežnej analýze (medián doby sledovania pre všetky pacienti 37,8 mesiaca (rozsah 2,7 – 48,0 mesiacov), HR = 0,63 (95 % CI, 0,48 – 0,82; p-hodnota 0,00031)).5
Aktualizované EFS1
Medián sledovania 75,1 mesiaca (rozsah 65,9 – 84,0 mesiaca).
OBMEDZENIA: Nebolo plánované žiadne formálne štatistické testovanie pre analýzu EFS špecifickú pre tento protokol, a preto nie je možné vyvodiť žiadne závery.
EFS po 75,1 mesiacoch v štúdii KEYNOTE-522

Kaplanova-Meierova krivka EFS 75,1 mesiaca
(rozsah 65,9 – 84 0 mesiaca)

Zdroj: Schmid et al. Overall Survival With Pembrolizumab in Early-Stage Triple-Negative Breast Cancer. N Engl J Med. 2024 Nov 28;391(21):1981-1991. Massachusetts Medical Society. Dotlač s povolením od Massachusetts Medical Society.

Po mediáne sledovania ~ 6 rokov bolo u pacientov, ktorí dostávali kompletný liečebný režim KEYTRUDA®, prežívanie bez udalostí (EFS) v súlade s výsledkami predchádzajúcej analýzy.
aChemoterapia: karboplatina a paklitaxel, po ktorých nasleduje doxorubicín alebo epirubicín s cyklofosfamidom.
dNa základe Miettinenovej a Nurminenovej metódy stratifikovanej podľa stavu uzlín, veľkosti nádoru a výberu karboplatiny.
e Na základe vopred špecifikovanej záverečnej analýzy pCR (v porovnaní s hladinou významnosti 0,0028).
fJednostranná hodnota p pre testovanie. H0: rozdiel v % = 0 v porovnaní s H1: rozdiel v % > 0.
gNa základe Coxovho regresného modelu s Efronovou metódou spájania s liečbou ako kovariátom stratifikovaným podľa stavu uzlín, veľkosti nádoru a výberu karboplatiny.
AC: doxorubicín + cyklofosfamid; CI: interval spoľahlivosti, EC: epirubicín + cyklofosfamid; EFS: prežívanie bez udalosti; HR: pomer rizika pCR: kompletná patologická reakcia.

Výsledky 7. priebežnej analýzy štúdie KEYNOTE-522 prvýkrát ukazujú zlepšenie celkovej miery prežívania u pacientov s eTNBC s liečebným režimom KEYTRUDA® v porovnaní s placebom.1
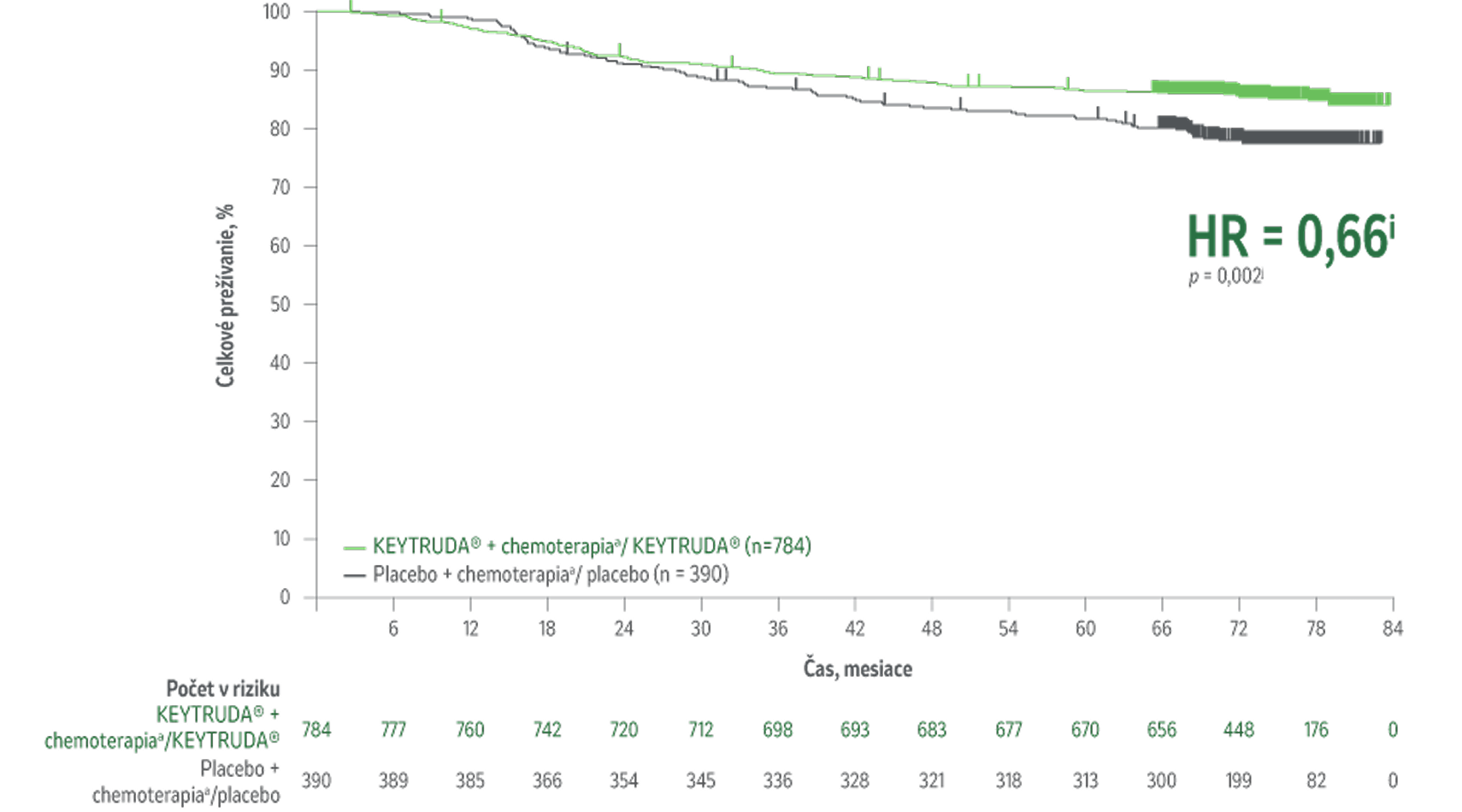
Celková miera prežívania1
Lepšie celková miera prežívaniah u pacientov liečených liečebným režimom KEYTRUDA® v porovnaní s placebom + chemoterapioua/placebom.
34 % zníženie (HR = 0,66i; 95 % CI,0,50-0,87; p = 0,002j) rizika úmrtia pri liečbe KEYTRUDA® + chemoterapiaa/KEYTRUDA® v porovnaní s placebom + chemoterapioua/placebom.
Medián sledovania 75,1 mesiaca (rozsah 65,9 – 84,0 mesiaca).
Kaplanova-Meierova krivka celkovej miery prežívaniaj podľa liečebnej skupiny v štúdii KEYNOTE-522 (populácia určená na liečbu)
Prevzaté z The New England Journal of Medicine, Schmid et al. Overall Survival With Pembrolizumab in Early-Stage Triple-Negative Breast Cancer. N Engl J Med.
2024;391(21):1981-1991. Autorské práva © 2024. Massachusetts Medical Society. Dotlač s povolením od Massachusetts Medical Society.
Počet pacientov s udalosťou (n/N) bol 115/784 (14,7 %) s KEYTRUDA® + chemoterapiou/KEYTRUDA® v porovnaní s 85/390 (21,8%) s placebom + chemoterapioua /placebom.1

KEYTRUDA® je prvý a zároveň jediný režim založený na imunoterapii, ktorý preukázal štatisticky významné zlepšenie celkového prežívania ako neoadjuvantná liečba s kombinovaným režimom KEYTRUDA®, po ktorom nasledoval liek KEYTRUDA® v monoterapii ako adjuvantná liečba po chirurgickom zákroku, v porovnaní s neoadjuvantnou chemoterapioua, po ktorej nasledovalo placebo po chirurgickom zákroku u pacientov s vysokorizikovým eTNBC.1,5-10,12-14
Údaje o celkovej miere prežívania u pacientov s liečbou KEYTRUDA® + chemoterapioua/KEYTRUDA® v porovnaní s placebom + chemoterapioua/placebom v rámci vopred špecifikovaných podskupín pri mediáne sledovania 75,1 mesiaca.1
OBMEDZENIA: Štúdia KEYNOTE-522 nebola schopná zistiť rozdiely v účinku liečby v týchto podskupinách a pre túto analýzu nebolo plánované žiadne štatistické testovanie; preto nie je možné vyvodiť žiadne závery. Výsledky týchto prieskumných analýz podskupín by sa mali interpretovať opatrne vzhľadom na malý počet pacientov, potenciálne nerovnováhy v základných charakteristikách v rámci podskupín a vzhľadom na to, že v tejto analýze neplatil predpoklad proporcionálneho rizika.

aChemoterapia: karboplatina a paklitaxel, po ktorých nasleduje doxorubicín alebo epirubicín s cyklofosfamidom.
hNa základe vopred špecifikovanej priebežnej analýzy OS (v porovnaní s úrovňou významnosti 0,00503)
iVážený priemerný pomer rizika s váhami počtu udalostí pred a po 2 rokoch následného sledovania bol 0,66.
jNa základe log-rank testu stratifikovaného podľa stavu uzlín, veľkosti nádoru a výberu karboplatiny.
CI: interval spoľahlivosti; CPS: kombinované pozitívne skóre; eTNBC: skoré štádium trojnásobne negatívneho karcinómu prsníka; HR: pomer rizika; PD-L1: ligand receptora programovanej bunkovej smrti 1.

Štúdia KEYNOTE-522 preukázala štatisticky významné zlepšenie celkovej miery prežívania, čo znamená viac „zajtrajškov“ pre pacientov, ktorí dostávali kompletný režim s liekom KEYTRUDA®, v porovnaní s tými, ktorí dostávali placebo.1

Dôležitý je starostlivý výber pacientov a monitorovanie toxicity.
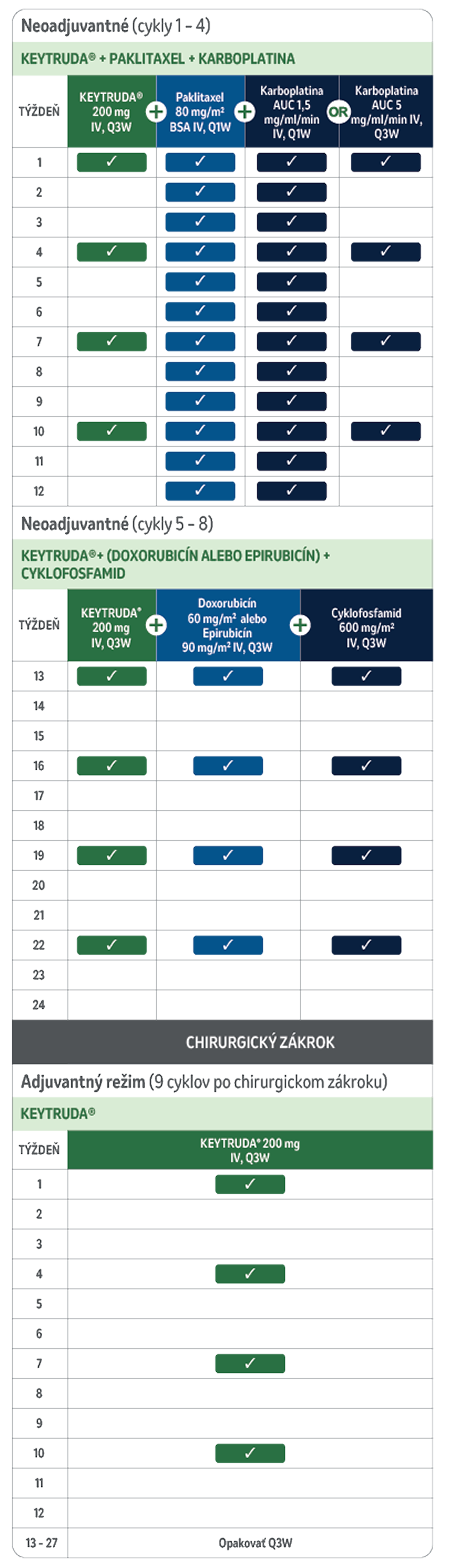
Odporúčaná dávka lieku KEYTRUDA® u dospelých je buď 200 mg každé 3 týždne alebo 400 mg každých 6 týždňov5
Pri podávaní lieku KEYTRUDA® ako súčasť kombinovanej liečby s intravenóznou chemoterapiou sa má KEYTRUDA® podávať ako prvá vo forme intravenóznej infúzie počas 30 minút. Pri neoadjuvantnej a adjuvantnej liečbe skorého štádia vysokorizikového TNBC sa majú pacienti liečiť neoadjuvantne liekom KEYTRUDA® v kombinácii s chemoterapiou 8 dávkami po 200 mg každé 3 týždne alebo 4 dávkami po 400 mg každých 6 týždňov alebo do progresie ochorenia, ktorá vylučuje definitívny chirurgický zákrok, alebo do neakceptovateľnej toxicity, po ktorej nasleduje adjuvantná liečba liekom KEYTRUDA® vo forme monoterapie s 9 dávkami po 200 mg každé 3 týždne alebo 5 dávkami po 400 mg každých 6 týždňov, alebo do recidívy ochorenia alebo neakceptovateľnej toxicity. Pacienti, u ktorých sa vyskytne progresia ochorenia, ktorá vylučuje definitívny chirurgický zákrok, alebo neakceptovateľná toxicita súvisiaca s liekom KEYTRUDA® ako neoadjuvantnou liečbou v kombinácii s chemoterapiou, by nemali dostávať monoterapiu liekom KEYTRUDA® ako adjuvantnú liečbu.
Zníženie dávky lieku KEYTRUDA® sa neodporúča. V prípade stredne závažných až závažných nežiaducich reakcií pozastavte alebo ukončite podávanie lieku KEYTRUDA® podľa odporúčaní uvedených v označení lieku.
AUC: oblasť pod krivkou; BSA: plocha povrchu tela; IV: intravenózna; Q1W: každý týždeň; Q3W: každé 3 týždne; Q6W: každých šesť týždňov; TNBC: trojnásobne negatívny karcinóm prsníka.

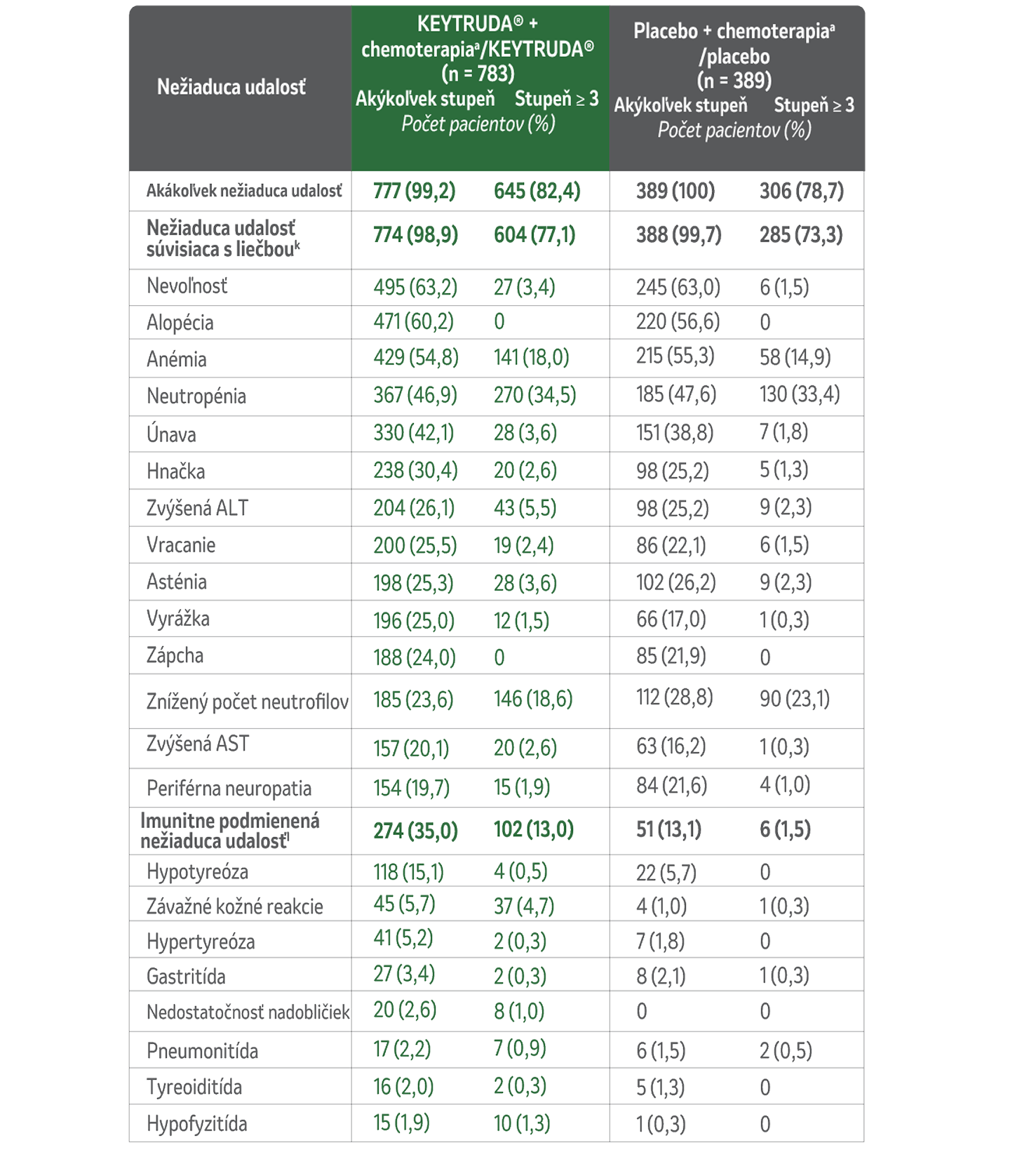
Súhrn bezpečnostného profilu neoadjuvantnej liečby KEYTRUDA® + chemoterapia s následnou adjuvantnou monoterapiou KEYTRUDA® pre TNBC1
U pacientov so skorým štádiom vysokorizikového TNBC, ktorí dostávali liek KEYTRUDA® v kombinácii s chemoterapioua ako neoadjuvantnú liečbu, po ktorej nasledovala monoterapia ako adjuvantná liečba, sa počas liečby alebo do 30 dní po jej ukončení (do 90 dní v prípade závažných udalostí) vyskytli nežiaduce udalosti uvedené v tomto zozname v zostupnom poradí podľa frekvencie v skupine KEYTRUDA® + chemoterapiaa /KEYTRUDA®. Reálne liečená populácia zahŕňala všetkých pacientov, ktorí podstúpili randomizáciu a dostali aspoň jeden skúšaný liek, podstúpili chirurgický zákrok, alebo oboje. Závažnosť nežiaducich udalostí bola hodnotená podľa CTCAE, verzia 4.0, NCI.1
Nežiaduce udalosti v kombinovanej neoadjuvantnej a adjuvantnej fáze
(medián sledovania 75,1 mesiaca)1
Nežiaduce udalosti 5. stupňa súvisiace s liečbou boli sepsa a syndróm multiorgánovej dysfunkcie (n = 1), pneumonitída (n= 1), pľúcna embólia (n = 1), autoimunitná encefalitída (n = 1) v skupine KEYTRUDA® + chemoterapiaa/KEYTRUDA® a septický šok (n = 1) v skupine placebo + chemoterapiaa/placebo.
Imunitne podmienené nežiaduce udalosti 5. stupňa boli pľúcna embólia (n = 1) a autoimunitná encefalitída (n = 1) v skupine KEYTRUDA® + chemoterapiaa/KEYTRUDA®.
aChemoterapia: karboplatina a paklitaxel, po ktorých nasleduje doxorubicín alebo epirubicín s cyklofosfamidom.
kNežiaduce udalosti súvisiace s liečbou boli udalosti, ktoré skúšajúci pripisovali liečbe v rámci štúdie. Uvádzajú sa nežiaduce udalosti súvisiace s liečbou, ktoré sa vyskytli minimálne u 20 % pacientov v ktorejkoľvek liečebnej skupine. Pacienti mohli mať viac ako jednu udalosť.
IImunitne podmienené nežiaduce udalosti sa určili podľa zoznamu pojmov špecifikovaných zadávateľom bez ohľadu na to, či ich skúšajúci priradili k akejkoľvek liečbe v rámci štúdie. Uvádzajú sa imunitne podmienené nežiaduce udalosti, ktoré sa vyskytli minimálne u 15 pacientov v ktorejkoľvek liečebnej skupine.
ALT: alanine aminotransferase; AST: aspartate aminotransferase; CTCAE: Common Terminology Criteria for Adverse Events; NCI: National Cancer Institute; TNBC: triple-negative breast cancer.
Šance svojich pacientov na lepšie výsledky môžete zvýšiť tým, že budete spolupracovať s MDT a tak im ponúknete väčšiu podporu v každej fáze ich liečebného režimu.16-19

Väčšinu prípadov karcinómu prsníka v skorom štádiu možno vyliečiť multimodálnou liečbou, hoci miera vyliečenia sa líši podľa klinického štádia a podtypu.15

Rozhodnutie o použití neoadjuvantnej a/alebo adjuvantnej liečby by mal prijať MDT.16

Rozhodovanie podľa MDT zvyšuje šance na lepšie výsledky pre vaše pacienti.17-18

Usmernenia ESMO odporúčajú zvoliť prístup MDT.15
Neoadjuvantná liečba KEYTRUDA® + chemoterapiaa s následnou adjuvantnou monoterapiou KEYTRUDA® sa odporúča u:
pacientov s ochorením cT2c-T4 s negatívnymi uzlinamim
pacientov s akýmkoľvek TNBC
s pozitívnymi uzlinami (štádium II-III)

Adjuvantná monoterapia liekom KEYTRUDA® sa odporúča u všetkých pacientov, ktoré dostali liek KEYTRUDA® + chemoterapiua v neoadjuvantnej liečbe, bez ohľadu na stav pCR.15
Usmernenia ESMO týkajúce sa používania lieku KEYTRUDA® u pacientov s eTNBC nájdete na webovej stránke ESMO.
aChemoterapia: karboplatina a paklitaxel, po ktorých nasleduje doxorubicín alebo epirubicín s cyklofosfamidom.
mPokiaľ neexistujú rizikové faktory pre nadmernú imunitnú toxicitu spojenú s ICI.
EFS: prežívanie bez udalosti; ESMO: Európska spoločnosť pre lekársku onkológiu; eTNBC: skoré štádium trojnásobne negatívneho karcinómu prsníka; MDT: multidisciplinárny tím; pCR: kompletná patologická odpoveď.
Referencie:
- Schmid P, Cortes J, Dent R, et al. Overall survival with pembrolizumab in early-stage triple-negative breast cancer. N Engl J Med. 2024;391(21):1981-1991.
- Stuart-Harris R, Dahlstrom JE, Gupta R, et al. Recurrence in early breast cancer: analysis of data from 3,765 Australian women treated between 1997 and 2015. Breast. 2019;44:153-9.
- Gupta GK, Collier AL, Lee D, et al. Perspectives on triple-negative breast cancer: current treatment strategies, unmet needs, and potential targets for future therapies. Cancers (Basel). 2020;12(9).
- Newton EE, Mueller LE, Treadwell SM, et al. Molecular targets of triple-negative breast cancer: where do we stand? Cancers (Basel). 2022;14(3).
- SPC KEYTRUDA® 10/2025.
- Opdivo®. Summary of product characteristics.
- Libtayo®. Summary of product characteristics.
- Tevimbra®. Summary of product characteristics.
- ZYNYZ®. Summary of product characteristics.
- Jemperli®. Summary of product characteristics.
- Schmid P, Cortes J, Pusztai L, et al. Pembrolizumab for early triple-negative breast cancer. N Engl J Med. 2020;382(9):810-21.
- Tecentriq®. Summary of product characteristics.
- Imfinzi®. Summary of product characteristics.
- Bavencio®. Summary of product characteristics.
- Loibl S, André F, Bachelot T, et al. Early breast cancer: ESMO clinical practice guideline for diagnosis, treatment and follow-up. Ann Oncol. 2024;35(2):159-82.
- Cain H, Macpherson IR, Beresford M, et al. Neoadjuvant therapy in early breast cancer: treatment considerations and common debates in practice. Clin Oncol (R Coll Radiol). 2017;29(10):642-52.
- Croke JM, El-Sayed S. Multidisciplinary management of cancer patients: chasing a shadow or real value? An overview of the literature. Curr Oncol. 2012;19(4):e232-8.
- Kesson EM, Allardice GM, George WD, et al. Effects of multidisciplinary team working on breast cancer survival: retrospective, comparative, interventional cohort study of 13,722 women. BMJ. 2012;344:e2718.
Výdaj lieku je viazaný na lekársky predpis. Pred predpísaním si prosím preštudujte Súhrn charakteristických vlastností lieku.
