KN-177
Indikácia: KEYTRUDA® je v monoterapii indikovaná dospelým s MSI-H alebo dMMR kolorektálnym karcinómom v nasledujúcich podmienkach:
- liečba prvej línie metastatického kolorektálneho karcinómu;
- liečba neresekovateľného alebo metastatického kolorektálneho karcinómu po predchádzajúcej kombinovanej liečbe na báze fluórpyrimidínu.1
Indikačné obmedzenie hradenej liečby platné od 1. júla 20243:
(kód indikačného obmedzenia I01328)
Liečba liekom KEYTRUDA® (pembrolizumab):
- je v monoterapii indikovaná v prvej línii metastatického kolorektálneho karcinómu u dospelých pacientov s MSI-H (microsatellite instability-high) alebo dMMR (mismatch repair deficient) kolorektálnym karcinómom, maximálne v trvaní 24 mesiacov.3
Hradená liečba podlieha predchádzajúcemu súhlasu zdravotnej poisťovne.
Podmienky úhrady3:
- 1L monoterapia mCRC
- Potvrdená mutácia MSI-H / dMMR
- Bez potreby testovania PD-L1
- Bez obmedzenia statusu ECOG
Dizajn štúdie KEYNOTE-1771
Klinická štúdia porovnávajúca liek KEYTRUDA vs. štandardná chemoterapia (± bevacizumab, cetuximab)1
Multicentrické, randomizované, otvorené, aktívnym komparátorom kontrolované klinické skúšanie fázy 3
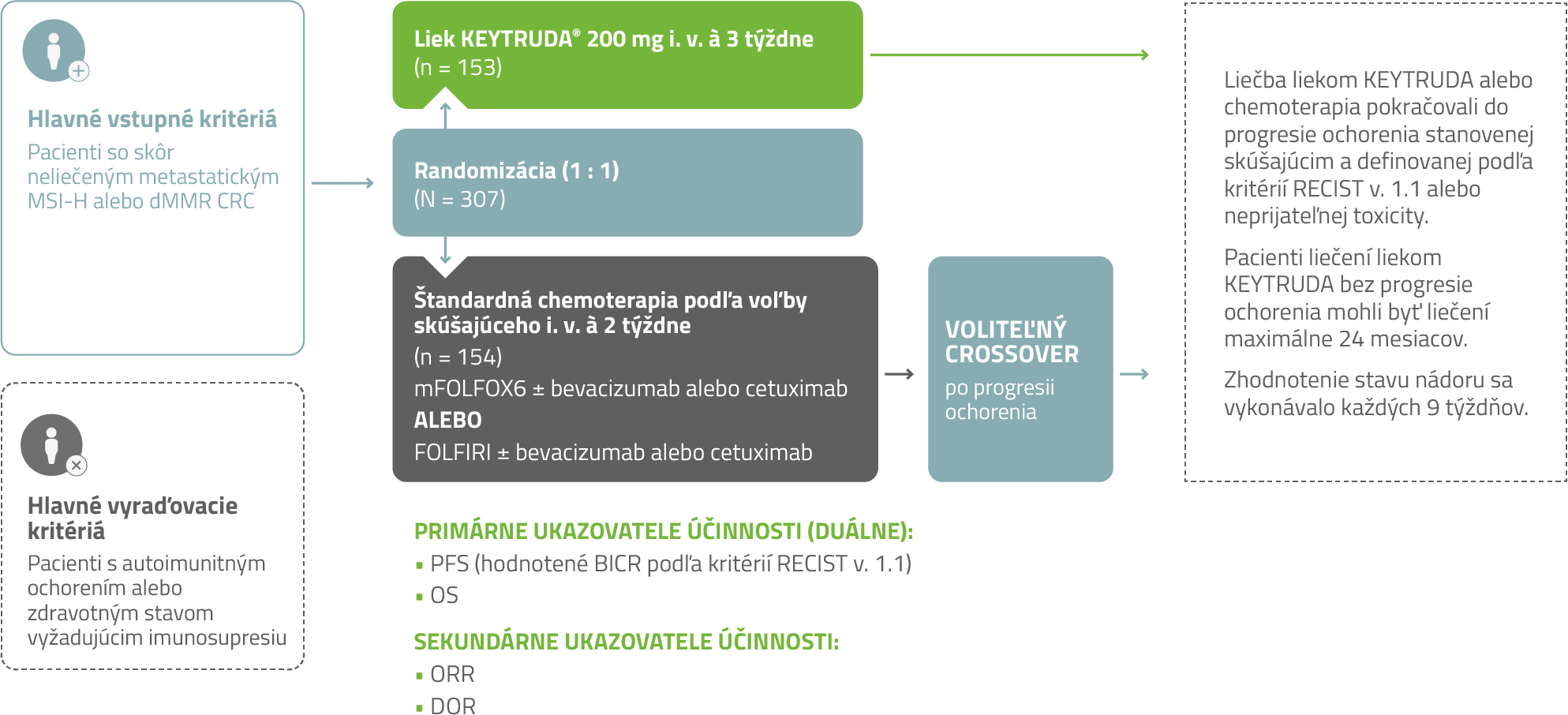
mFOLFOX6: leukovorín, 5-FU, oxaliplatina (modifikovaný režim)
FOLFIRI: leukovorín, 5-FU, irinotekán
Upravené podľa súhrnu údajov o lieku KEYTRUDA®.
– Stav MSI alebo MMR (oprava chybne spárovaných báz) v nádore bol stanovený lokálne s použitím polymerázovej reťazovej reakcie (polymerase chain reaction,
PCR) alebo IHC.
– Pacientom randomizovaným do skupiny na chemoterapiu sa po progresii ochorenia ponúkla liečba liekom KEYTRUDA®.
Vstupné charakteristiky pacientov v populácii ITT1
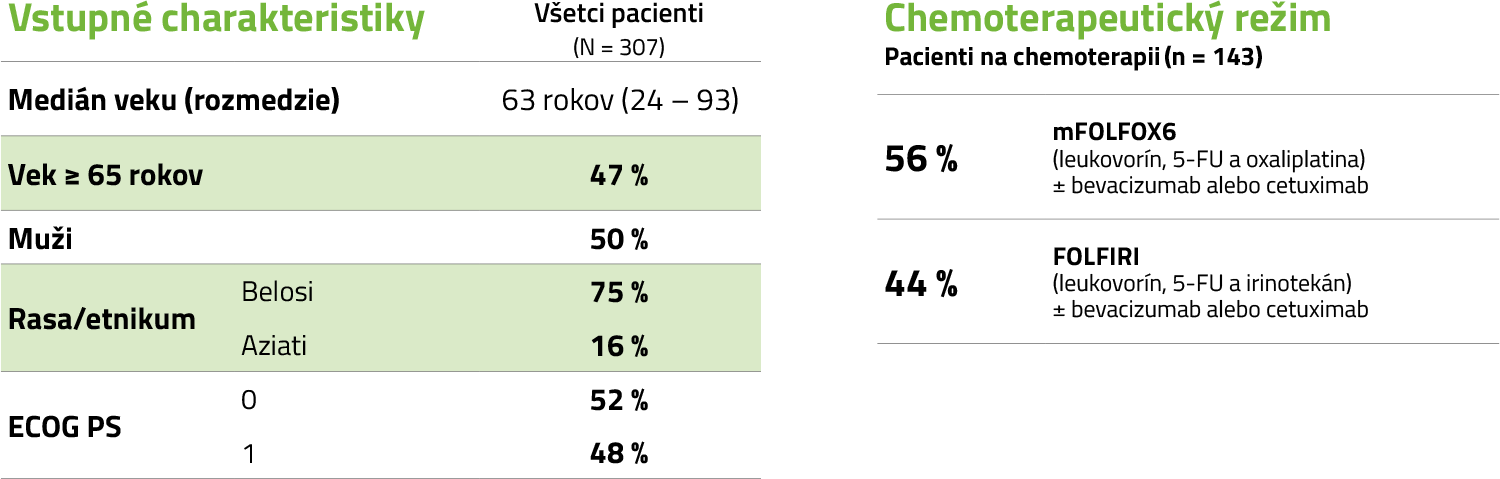
Upravené podľa súhrnu údajov o lieku SPC KEYTRUDA®.
KEYNOTE-177: Kaplan-Meierove krivky PFS (duálny primárny cieľ s OS) v populácii so zámerom liečiť (ITT)1
41 % redukcia rizika progresie ochorenia s liekom KEYTRUDA® vs. štandardná chemoterapia (± bevacizumab, cetuximab)*,1
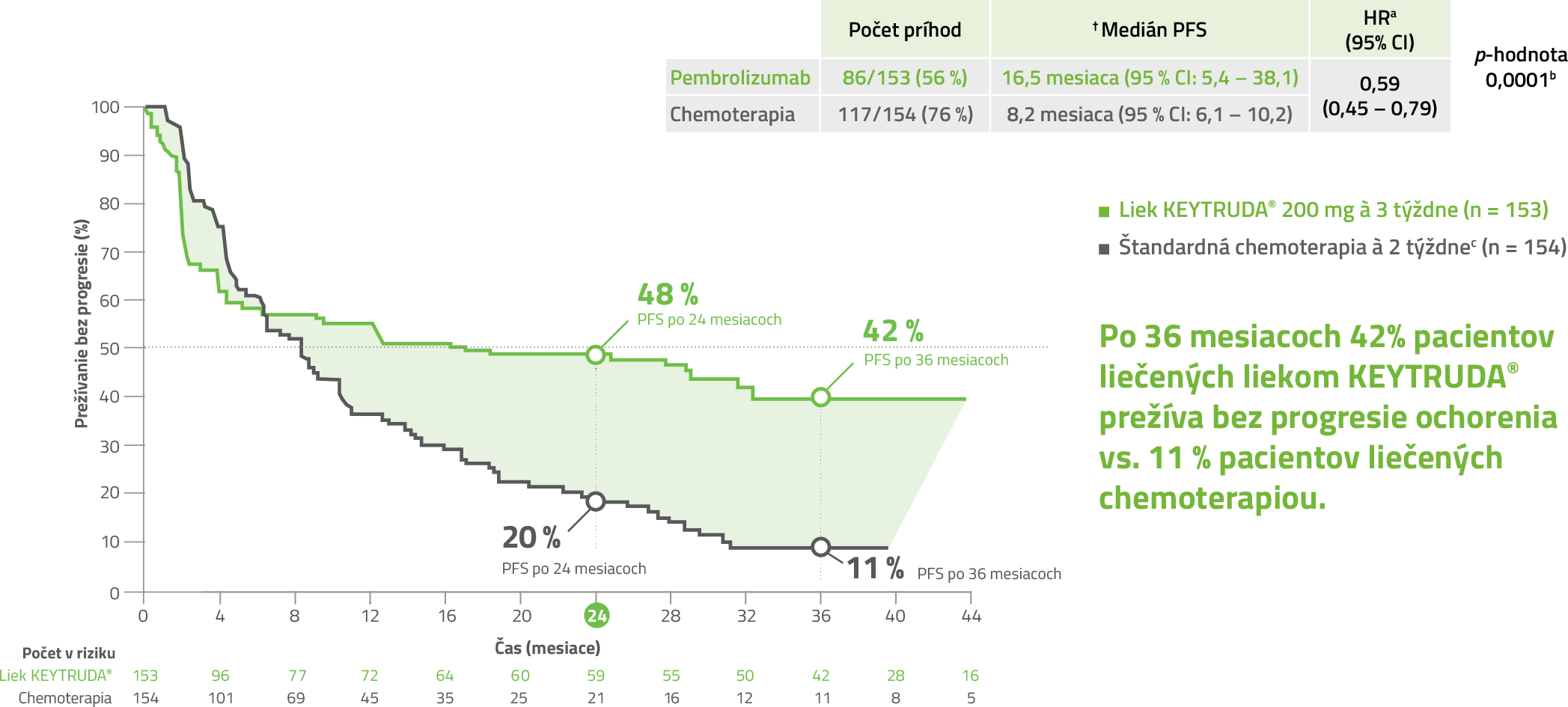
* HRa: 0,59 (95 % CI: 0,45 – 0,79; pb = 0,0001)
Upravené podľa súhrnu údajov o lieku SPC KEYTRUDA®.
Celkové prežívanie (OS, duálny primárny cieľ s PFS)1
KEYNOTE-177: OS (Overall survival) finálna analýza
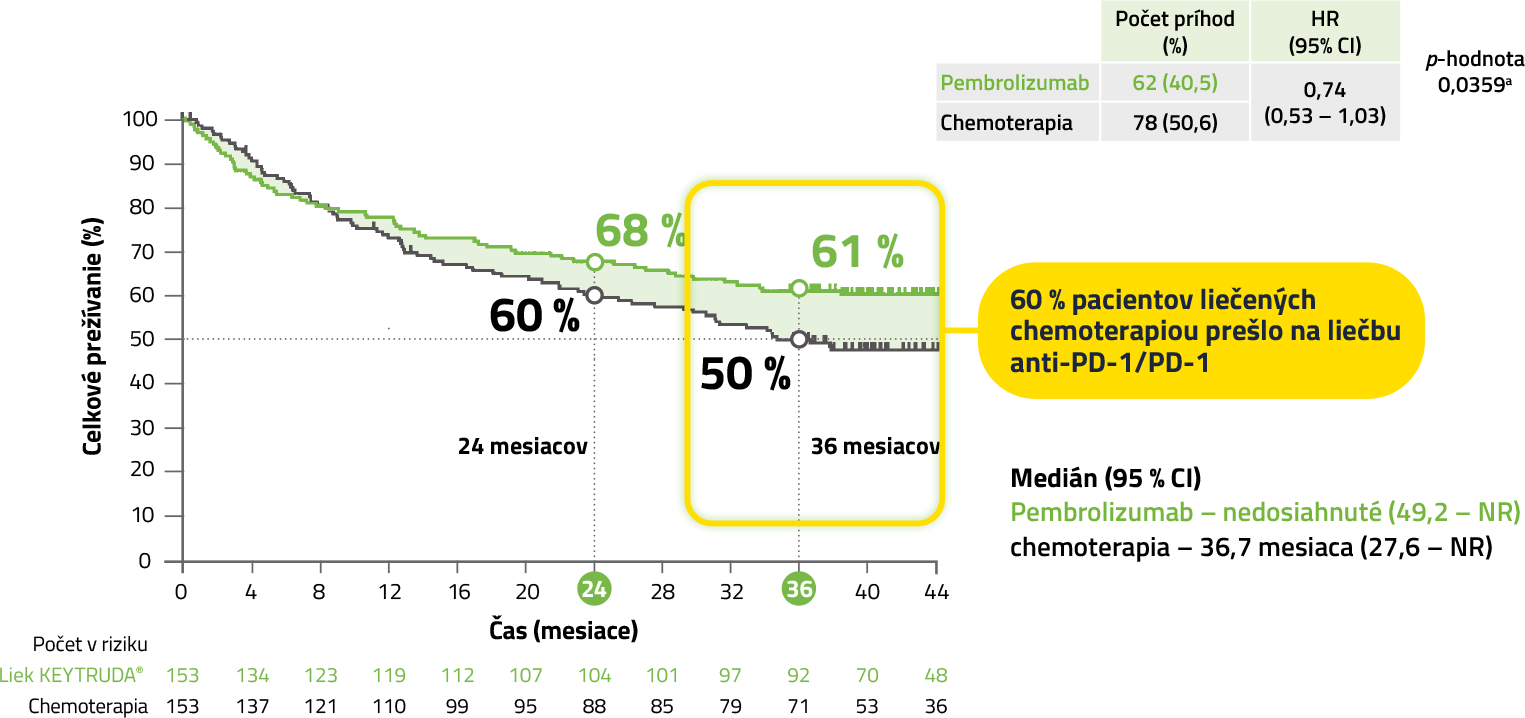
a Po upravení vzhľadom na multiplicitu štatisticky nevýznamné
KEYNOTE-177: sekundárne cieľové ukazovatele v populácii so zámerom liečiť (ITT)1
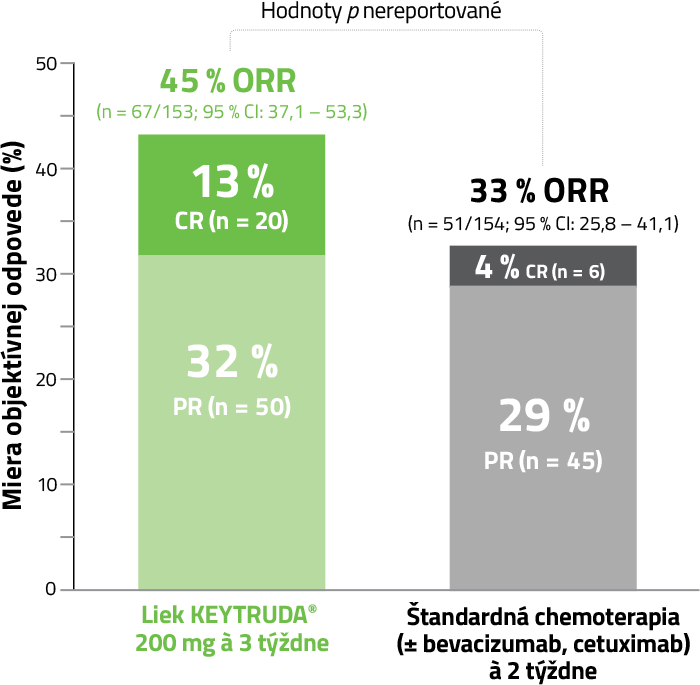
U pacientov s liečebnou odpoveďou a na základe Kaplan-Meierových odhadov:
Medián dĺžky trvania odpovede (rozmedzie)*
pembrolizumab – nedosiahnutý (2,3+ až 53,5+ mesiaca)
chemoterapia – 10,6 mesiaca (2,8 až 48,3+ mesiaca)
U pacientov s odpoveďou, na základe pozorovaného trvania odpovede:
Dĺžka trvania odpovede % s trvaním ≥ 24 mesiacov*
pembrolizumab 84 %
chemoterapia 34 %
* Na základe Kaplanovho-Meierovho odhadu.
KEYNOTE-177: súhrn nežiaducich reakcií2
Nežiaduce reakcie s výskytom u ≥ 10 % pacientov v ktorejkoľvek skupine v liečenej populácii2
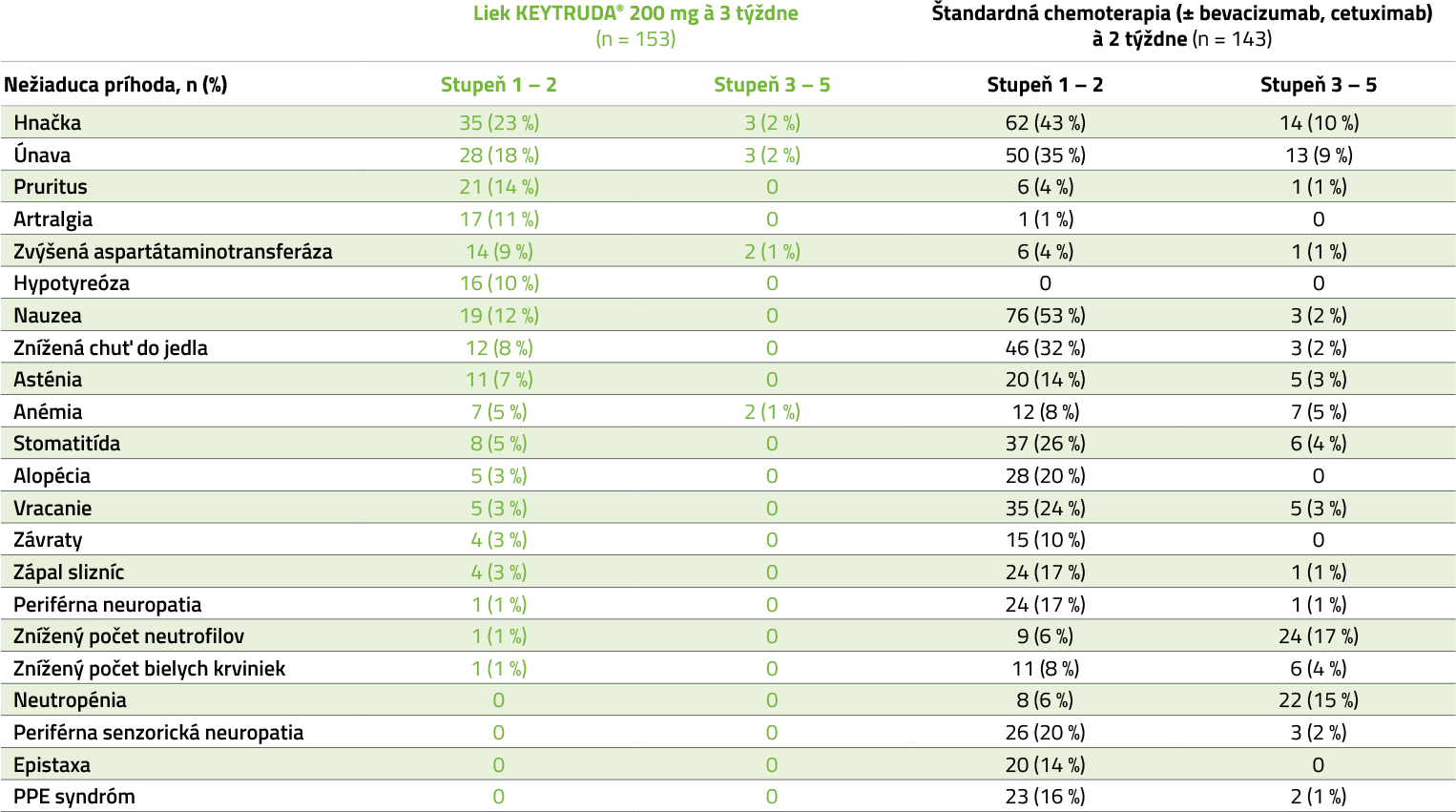
KEYNOTE-177: nežiaduce reakcie s výskytom u ≥ 10 % pacientov v ktorejkoľvek skupine v liečenej populácii2
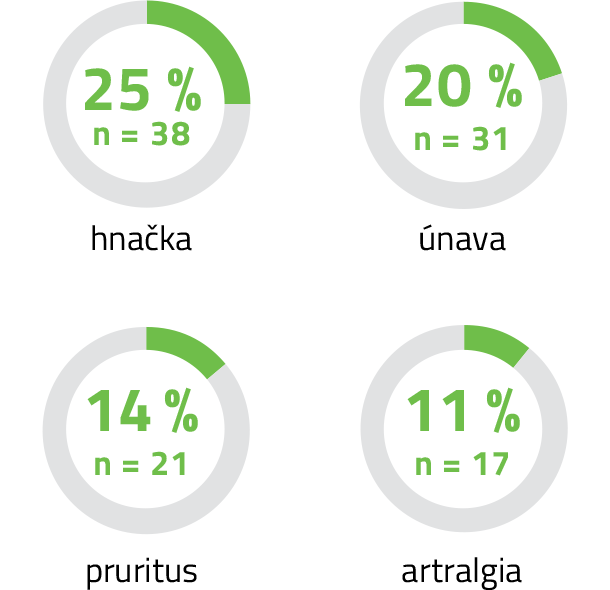
Nežiaduce reakcie s najvyššou incidenciou u pacientov liečených liekom KEYTRUDA®: 2
Nežiaduce reakcie s najvyššou incidenciou u pacientov liečených štandardnou chemoterapiou (± bevacizumab, cetuximab):2

KEYNOTE-177: nežiaduce reakcie zvláštneho záujmu vrátane imunitne sprostredkovaných nežiaducich reakcií a infúznych reakcií2
Porovnanie incidencie TRAE stupňa ≥ 3 s liekom KEYTRUDA® so štandardnou chemoterapiou (±bevacizumab, cetuximab)2
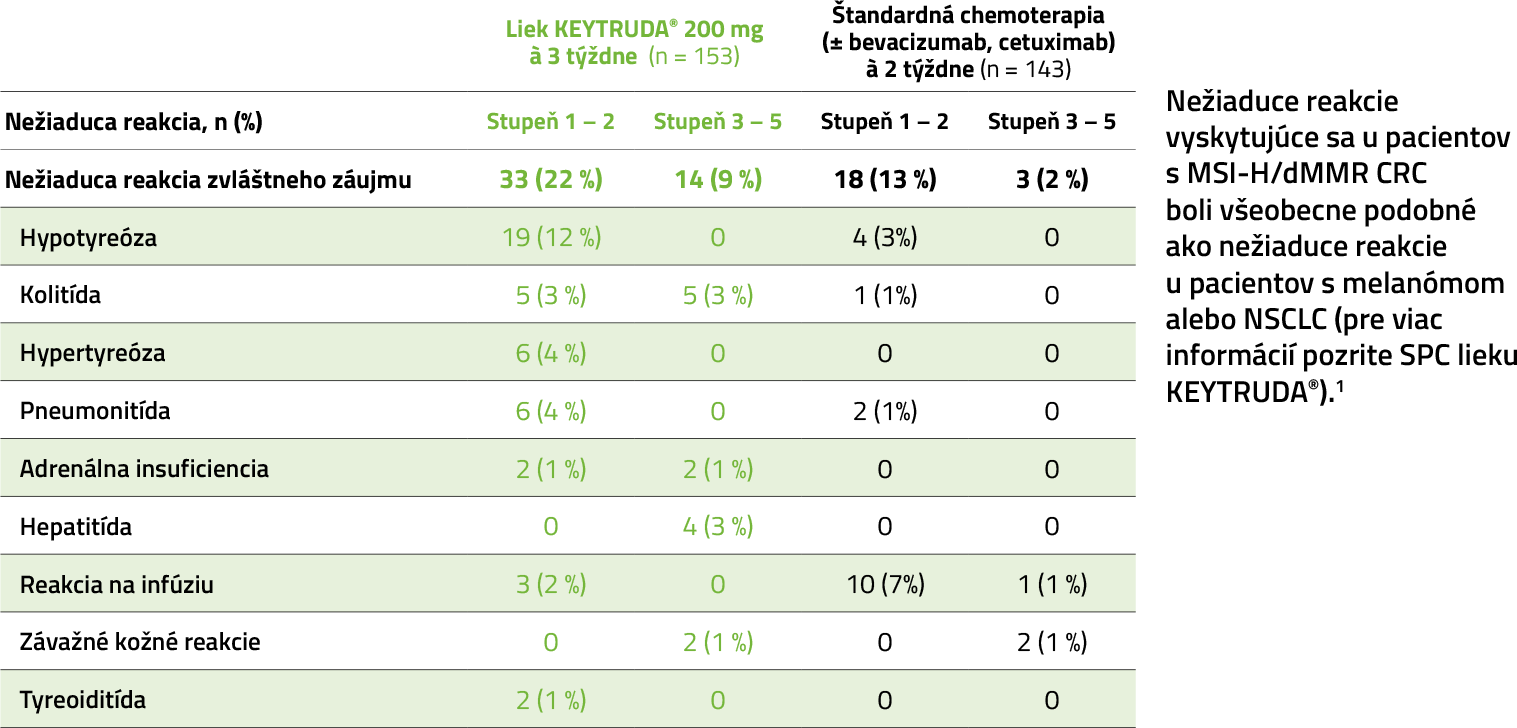
Nežiaduce reakcie vyskytujúce sa u pacientov s MSI-H/dMMR CRC boli všeobecne podobné ako nežiaduce reakcie u pacientov s melanómom alebo NSCLC (pre viac informácií pozrite SPC lieku KEYTRUDA®).1
Liek KEYTRUDA® je indikovaný v prvej línii liečby u pacientov
s metastatickým MSI-H alebo dMMR CRC.1
41%
redukcia rizika progresie ochorenia alebo úmrtia
s liekom KEYTRUDA® vs. štandardná chemoterapia (± bevacizumab, cetuximab)a (HRb : 0,59; 95 % CI: 0,45 – 0,79; pc = 0,0001)1
Po 36 mesiacoch 42% pacientov liečených liekom KEYTRUDA® prežíva bez progresie ochorenia vs. 11% pacientov liečených chemoterapiou.1
a Podľa voľby skúšajúceho buď mFOLFOX6 (leukovorín, 5-FU a oxaliplatina) ± bevacizumab alebo cetuximab, alebo FOLFIRI (leukovorín, 5-FU a irinotekán) ± bevacizumab alebo cetuximab.
b Na základe Coxovho regresného modelu.
c Dvojstranné, na základe log rank testu (hranica významnosti 0,0234). Jednostranná hodnota p je 0,0002.
Skratky:
5-FU: 5-fluorouracil. ALT: alanínaminotransferáza. AST: aspartátaminotransferáza. BICR: zaslepené nezávislé centrálne hodnotenie. CI: interval spoľahlivosti. CR: kompletná odpoveď. CRC: kolorektálny karcinóm. dMMR: deficit systému opravy chybného párovania báz. DoR: trvanie odpovede. ECOG PS: výkonnostný stav podľa Eastern Cooperative Oncology Group. FOLFIRI: leukovorín, 5-FU, irinotekán. HR: pomer rizík. mFOLFOX6: leukovorín, 5-FU, oxaliplatina (modifikovaný režim). MMR: systém opravy chybného párovania báz. MSI: mikrosatelitová nestabilita. MSI-H: vysoká mikrosatelitová nestabilita. NSCLC: nemalobunkový karcinóm pľúc. ORR: miera objektívnej odpovede. OS: celkové prežívanie. PFS: prežívanie bez progresie. PPE: palmoplantárna erytrodyzestézia. PR: čiastočná odpoveď. RECIST: kritériá hodnotenia odpovede na liečbu pri solídnych nádoroch. TRAE: nežiaduca príhoda súvisiaca s liečbou.
Referencie:
1. Súhrn charakteristických vlastností lieku KEYTRUDA®
2. Luis A Diaz Jr. et al. Pembrolizumab versus chemotherapy for microsatellite instability-high or mismatch repair-deficient metastatic colorectal cancer (KEYNOTE-177): final analysis of a randomised, open-label, phase 3 study. Lancet Oncol 2022; 23: 659 – 70.
3. Zoznam kategorizovaných liekov, časť B: Indikačné obmedzenia
Výdaj lieku je viazaný na lekársky predpis. Pred predpísaním si prosím preštudujte Súhrn charakteristických vlastností lieku.
